D-Glucose
(Dextrose, Traubenzucker, Kurzz.: D-Glc nach IUPAC/IUB)
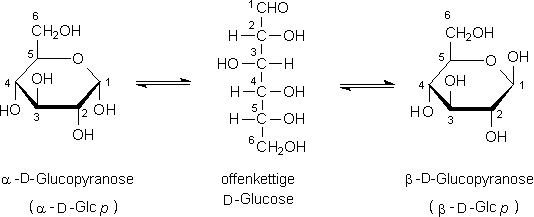
Farb- u. geruchlose, süß schmeckende Krist., D. 1,56. a-D-G.-Monohydrat (Hydratdextrose) hat Schmp. 83–86°, wasserfrei Schmp. 146° (Zers.), b-D-G. Schmp. 150°. In Wasser
ist G. sehr leicht, in Ether, Aceton u. Essigester nicht lösl.; die rechtsdrehende wäss. Lösung der D-G. zeigt Mutarotation, was auf die Bildung der beiden Anomeren, a- u. b-D-G. zurückzuführen
ist, die sich in der Konfiguration am Kohlenstoff-Atom 1 unterscheiden.
Neben der offenkettigen Form u. der pyranosiden 6-Ring-Formen kommen bei Zuckern noch furanoside 5-Ring-Formen vor, bei Glucose
allerdings in untergeordnetem Maße. Ähnliche Konfigurationsüberlegungen sind jedoch auch bei vielen anderen Zuckern u. Aminozuckern anzustellen, z.B. bei Mannose u. Galactose, die sich
als Epimere der G. von ihr in der Konfiguration (nur) eines Kohlenstoff-Atoms unterscheiden, das zudem nicht das glykosidische (hier: Position 1) ist. Die Zuordnung als „D“-G. hat nichts
mit dem optischen Drehsinn zu tun, sondern zeigt die Strukturverwandtschaft zu D-Glycerinaldehyd. Dasjenige asymmetrische Kohlenstoff-Atom mit der höchsten Positionszahl (hier: 5), das als deren
unterstes angeschrieben sein muß, entscheidet über die Zugehörigkeit zur D- od. L-Reihe, je nachdem ob die betreffende Hydroxy-Gruppe nach rechts od. nach links zeigt. Das L-G.-Mol.
ist übrigens das genaue Spiegelbild der D-Form, a-L-Glucopyranose hat zu a-D-Glucopyranose spiegelbildliche Struktur usw. Normalerweise liegt G. als Glucopyranose vor, u. die Aldehyd-Gruppe (daher
gehört G. zu den Aldosen, genauer: Aldohexosen) der offenkettigen tritt nur bei bestimmten Reaktionen in Funktion, z.B. wenn Fehlingsche Lösung durch G. reduziert wird.
Vorkommen:
D-G. ist in fast allen süßen Früchten (meist mit D-Fructose zu Saccharose verbunden) verbreitet, bes. auch in Weintrauben, woher sich der Name Traubenzucker ableitet. Sie nimmt auch
am Aufbau der im allg. in Einzelstichwörtern behandelten Di- u. Polysaccharide teil u. kann aus diesen durch Hydrolyse mit Hilfe von Säuren od. Enzymen gewonnen werden. Zu den wirtschaftlichen
Aspekten der G.-Gewinnung aus Cellulose u.a. natürlichen Quellen, vgl. Amylase, Glucose-Sirup, Holzverzuckerung, Invertzucker, Stärkezucker.
Außerdem ist D-G. am Aufbau physiologisch
wichtiger Glykolipide u. Glykoproteine beteiligt; phosphorylierte Deriv. der D-G. sind wichtige Stoffwechsel-Zwischenprodukte – man kann sagen, dass D-G. unter Berücksichtigung des Vork.
in Polysacchariden u. in Glykosiden die meistverbreitete org. Verb. auf der Erde ist. Durch Mikroorganismen kann D-G. zu Ethanol, Essig-, Milch-, Buttersäure vergoren werden, u. mit Aminosäuren
geht sie beim Erwärmen eine Maillard-Reaktion ein, was z.B. für die Ausbld. von Brot- u.a. Aromen von Bedeutung ist.
Physiologie:
Das menschliche Blut enthält normalerweise stets etwa 0,08–0,11% D-G. (Blutzucker) gelöst. Vor allem das Gehirn ist auf eine dauernde Zufuhr dieses Brennstoffs über das Blut angewiesen.
Eine Überschreitung dieses Zuckergehalts führt zu Hyperglykämie, verbunden mit Glucosurie (Auftreten von D-G. im Harn), eine Unterschreitung zu Hypoglykämie; die Konstanthaltung
der Blutzucker-Konz. wird durch Regelmechanismen ermöglicht, an denen Insulin, Glucagon u. der Chrom-haltige sog. Glucose-Toleranzfaktor (GTF) beteiligt sind. Bei Störungen dieser Regulation
kann es durch ein Unterangebot von Insulin zu Diabetes (Zuckerkrankheit) kommen. Die etwa vom 45. Lebensjahr an verminderte Durchlässigkeit der Blut-Gehirn-Schranke für D-G. wird beim Menschen
für einige der typischen Alterserscheinungen verantwortlich gemacht. Außerdem kann G. in nichtenzymatischer Reaktion Proteine zu nicht abbaubaren Produkten quervernetzen u. mag damit am irreversiblen
Vorgang des Alterns beteiligt sein . Transport:
D-G. wird in den meisten Zellen durch erleichterte Diffusion (passiven Transport), in Niere u. Darm jedoch zusätzlich durch aktiven Transport in die Zelle aufgenommen. Die erleichterte Diffusion
wird durch ein membranständiges Transportermolekül (ein Glykoprotein) vermittelt. Das Hormon Insulin stimuliert den Transport durch Erhöhung der Anzahl der in der Membran vorhandenen
Transportermoleküle in Muskel- u. Fettgewebe . Cytochalasin B dagegen hemmt die Aktivität des Transporters. ACTH, Glucagon, Glucocorticoide, Isoproterenol u. Somatotropin vereiteln die Insulin-Wirkung
teilweise. Bei Diabetes Typ 2 u. bei Fasten scheint die Anzahl der Insulin-abhängigen G.-Transporter in peripherem Gewebe reduziert zu sein . Beim aktiven Na+/D-Glucose-Cotransport (Symport) in
Niere u. Dünndarm wird die Energie des Konzentrationsgefälles der Natrium-Ionen ausgenützt, um die daran gekoppelte Einschleusung von D-G.-Molekülen zu bewerkstelligen. Der Na+/D-Glucose-Cotransporter
des Dünndarm-Bürstensaums, dessen Aminosäure-Sequenz jetzt bekannt ist, zeigt keine Ähnlichkeit zu anderen bekannten Zucker-Transport-Proteinen. Stoffwechsel:
D-G. steht im Mittelpunkt des Kohlenhydrat-Stoffwechsels, der hier nicht im Detail besprochen werden kann. Als solche aufgenommene od. im Verdauungs-Apparat durch enzymatische Spaltung entstehende
D-G. wird in komplexen Reaktionsketten (Glykolyse) unter Energie-Gewinn zu kleineren Mol. abgebaut – stellvertretend sei die Brenztraubensäure genannt, die über Acetyl-CoA in den Citronensäure-Zyklus
eintreten kann – od. aber (Pentosephosphat-Weg od. -Zyklus) unter gleichzeitiger Bereitstellung von Reduktions-Äquivalenten für biosynthetische Zwecke in Deriv. anderer Zucker umgewandelt,
z.B. in solche der für die Synth. von Nucleinsäuren wichtige D-Ribose. Alternativ kann D-G. in Leber u. Muskel als Reservestoff Glykogen (in Pflanzen: Stärke) gespeichert werden, der
in Zeiten der Kohlenhydrat-Knappheit, angezeigt durch niedere Blutzuckerspiegel, zur Verfügung steht. Der Abbau des Reservestoffs in der Leber wird durch Glucagon initiiert, umgekehrt hemmen
hohe D-G.-Spiegel die Ausschüttung von Glucagon aus den a2-Zellen des Pankreas. Auch Brenztraubensäure kann zum Aufbau von (Blut-)G. dienen über einen Gluconeogenese genannten Prozeß.
Die Neusynth. von Glykogen aus D-G. in der Leber kann auf dem direkten od. einem indirekten (über Brenztraubensäure u. Gluconeogenese führenden) Weg erfolgen. Nachweis:
Der Nachw. von G. erfolgt in der Regel mit der Fehlingschen Lösung, Nylanders Reagenz, dem Trommerschen Test od. Benedict's Reagenz. Angesichts der weiten Verbreitung des Diabetes sind zahlreiche
Schnellnachw.-Meth. (Diagnostika) zur Best. von Blutzucker u. G. im Harn entwickelt worden; auch ohne Phosphorylierung direkt mit Glucosedehydrogenase (Reduktion von NAD+ zu NADH, das photometrisch
gemessen wird; od. mit Glucoseoxidase/Peroxidase (zugesetzte Redox-Indikatoren werden durch entstehendes Wasserstoffperoxid zu Farbstoffen oxidiert). Die letztgenannte Methode ist besonders für
Test-Stäbchen u. -Streifen geeignet u. läßt sich auch in der Harn-Unters. anwenden. Die enzymatischen Methoden verlaufen über D-Gluconsäure-5-lacton u. D-Gluconsäure bzw.
deren 6-Phospho-Derivate. Zur quant. D-G.-Best. im Harn kann auch die polarimetrische Messung der optischen Aktivität herangezogen werden.
Verwendung:
m, krist. Zustand als sog. Dextrose sowie in 5–50%iger Lösung als Glucose-Präp. in Ampullen in den Handel. Intravenöse Einspritzungen werden z.B. bei Herzmuskelentzündungen,
Erschöpfungserscheinungen, Verdauungsbeschwerden, zur parenteralen Ernährung usw. angewendet, wobei häufig auch Invertzucker-Lösungen benutzt werden. D-G. kann auch Bakterienwachstum
hemmen (dies bewirkt z.B. ein Zusatz von 10–35 g D-G. zu 100 g Nährlösung), daher setzt man sie verschiedenen Wundsalben zu. Größere Mengen von G. werden für chem. Synth.
(z.B. von Sorbit, Gluconsäure, Ascorbinsäure, Glutaminsäure u. Glutamat, Methylglucosid) u. techn. Zwecke verbraucht. Ein erheblicher Teil geht in Form von Glucose-Sirup in die Herst.
von Süßwaren, insbes. Zuckerwaren, wobei zunehmend sog. Isosirup (enzymatisch isomerisierter Glucose-Sirup) eingesetzt wird.
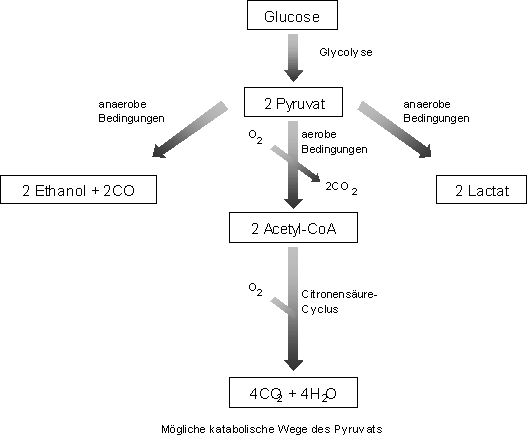
Glycolyse:
Hierunter versteht man den wichtigsten Abbauweg der ggf. aus den Reservestoffen Glykogen od. Stärke als a-D-Glucose-1-phosphat freigesetzten D-Glucose zu 2 Mol Pyruvat. Dieser katabolische Stoffwechselweg
liefert chem. Energie in Form von Adenosin-5'-triphosphat (ATP). Die gleichfalls entstehende reduzierte Form des Nicotinamid-Adenin-Dinucleotids, das NADH, wird bei Bakterien sowie unter anaeroben Bedingungen
z.B. im Muskel wieder oxidiert unter begleitender Reduktion von Pyruvat zu D- od. L-Lactat (Salzform der D- bzw. L-Milchsäure). In den Mitochondrien der Eukaryonten kann NADH andererseits in der
Atmungskette verwertet werden, während Pyruvat dort im Citronensäure-Zyklus unter weiterem Gewinn von ATP u. NADH zu Kohlendioxid oxidiert wird.
Aus energetischen Gründen u. zum Zwecke der gezielten Regulation besitzt die Gluconeogenese bei 3 Reaktionsschritten eigene Mechanismen u. Enzymsysteme. Die wichtigsten Zwischen- u. Endprod. dieser
Stoffwechselwege sind in Einzelstichwörtern behandelt. Nach den an der Aufklärung beteiligten Forschern wird die G. auch Embden-Meyerhof-Parnas(EMP)-Weg, nach dem Zwischenprod. D-Fructose-1,6-bisphosphat
(früher: Fructosediphosphat, FDP) auch FDP-Weg genannt.
Ein weiterer Weg des Zucker-Abbaus ist der Pentosephosphat-Weg. In anaeroben Bakterien entsteht D-Glucose-6-phosphat aus D-Glucose u. Phosphoenolpyruvat durch ein Phosphotransferase-System, was zu
einer cyclischen Form der G. Anlaß gibt.
Regulation:
G. u. Gluconeogenese laufen im Cytoplasma ab. Würden G. u. Gluconeogenese in der Leber ungehindert nebeneinander ablaufen, so wäre ein sinnloser ATP-Verbrauch die Folge. Daher ist eine abgestimmte
Regulation der beiden Stoffwechselwege erforderlich, damit der eine abgeschaltet wird, während der andere aktiviert ist. Eine Regulation erfolgt erstens durch das Ausmaß, in dem ihnen ihre
jeweiligen Substrate zur Verfügung stehen. Außerdem paßt sich der Organismus durch geregelte Neusynthese von Enzymen veränderten Stoffwechselsituationen an. Schließlich erfolgt
eine Kurzzeit-Regulation hormonbedingt durch Phosphorylierung-Dephosphorylierung von Enzymen u. die dadurch bedingte Änderung ihrer Aktivitäten sowie durch allosterische Effektoren. Einschlägige
Hormone sind Insulin, Glucagon u. Catecholamine. Während die beiden Letzteren die Gluconeogenese stimulieren u. die G. inhibieren (u. zwar sowohl über Adenosin-3',5'-monophosphat als auch
Ca2+ als second messenger), übt Insulin einen gegenläufigen Effekt aus.
Wichtige Schlüsselenzyme für allosterische Regulation sind Pyruvatkinase, 6-Phosphofructo-1-kinase, u. Fructose-1,6-bisphosphatase (s. D-Fructose-1,6-bisphosphat).
Ein bedeutender allosterischer Effektor ist neben ATP u. Adenosin-5'-diphosphat b-D-Fructose-2,6-bisphosphat. Überblick
Glucose entsteht normalerweise durch den Abbau komplexer Polysaccharide oder Disaccharide im Körper. Andererseits kann es auch Produkt einer Neusynthese aus ursprünglich anderen Stoffen als
Kohlenhydraten (Gluconeogenese) sein. Die Enzyme der Glycolyse sind weit im Cytosol verstreut, bilden also keine Komplexe. Die Einzelreaktionen lassen sich ihrem Sinn nach in mehrere Bereiche zusammenfassen:
- Reaktion1-5:
Vorbereitung.
Die Hexose Glucose wird erst phosphoryliert, dann zu zwei Molekülen der Triose Glycerinaldehyd-3-phosphat gespalten. Dieser Prozeß verbraucht zwei Moleküle ATP.
- Reaktion6-10:
Energiegewinnung.
Die beiden Triosen werden zu zwei Molekülen Pyruvat überführt. Dabei werden vier Moleküle ATP gewonnen.
Die Gesamtreaktion lautet:
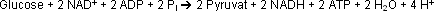
Die Glycolyse weist also einen Nettogewinn von zwei Molekülen ATP auf. Allerdings muß die Oxidationskraft des NAD+ zurückgewonnen werden. Normalerweise geschieht das auf einem von drei
Wegen:
- Im Muskel wird Pyruvat unter anaeroben Bedingungen zu Lactat reduziert. Dabei wird auch NAD+ regeneriert.
- In der Hefe wird Pyruvat unter anaeroben Bedingungen zu Acetaldehyd decarboxyliert, das
dann durch NADH zu Ethanol reduziert wird.
- Unter aeroben Bedingungen werden in den Mitochondrien aus einem Molekül NADH drei Moleküle ATP gewonnen.
-
Unter aeroben Bedingungen ist NADH demnach eine energiereiche Bindung, deren freie Enthalpie unter anaeroben Bedingungen jedoch verschwendet wird.
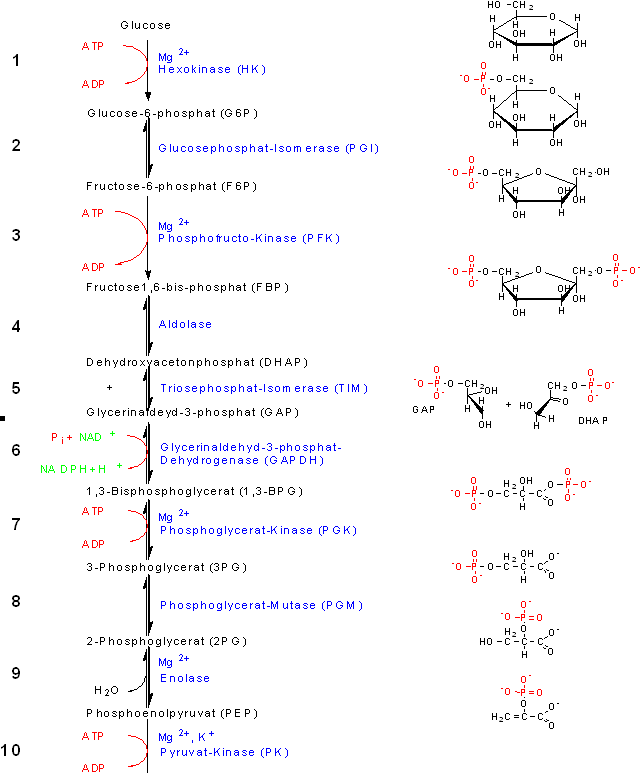
Reaktionen Reaktion 1: Hexokinase
n der Glycolyse wird aus Glucose Glucose-6-Phosphat (G6P). Dies geschieht, indem das Enzym Hexokinase eine Phosphorylgruppe von ATP auf die C(6)-OH Gruppe der Glucose überträgt.
Also:
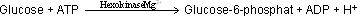
Reaktion 2: Glucosephosphat-Isomerase
Nun wird Glucose-6-phosphat zu Fructose-6-phosphat (F6P) isomerisiert. Die Glucosephosphat-Isomerase (PGI) arbeitet dabei auf Basis der Säure-Base-Katalyse in 4 Schritten:
- Ringöffnung des Zuckers mittels einer Säure.
- Abspaltung des Protons (H*) von C(2) à Bildung des sog. cis-Endiolats.
- Bindung des abgespaltenen Protons an C(1)
- Ringschluß
Reaktion 3: Phosphofructokinase
Die dritte Reaktion der Glycolyse wird Fructose-6-phosphat zu Fructose-1,6-bis-phosphat (FBP oder F1,6P) phosphoryliert. Diese Reaktion wird durch Phosphofructokinase katalysiert und ist ähnlich
der ersten Reaktion. Auch hier wird ATP verbraucht, was zu einer Zwischenbilanz von –2 ATP führt. Die Reaktionsgleichung lautet:
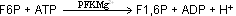
Reaktion 4: Aldolase
Das Enzym der vierten Reaktion, die Aldolase, spaltet F1,6P zu zwei Triosen, zu Glycerinaldehyd-3-phosphat (GAP) und zu Dihydroxyacetonphosphat (DHAP). Bei dieser Reaktion handelt
es sich um eine Adolspaltung, daher der Name des Enzyms. Aus der vierten Reaktion erklärt sich auch der Sinn von Reaktion 2. Erst durch sie führt Reaktion 4 zu zwei gleich langen Kohlenstoffketten. Reaktion 5: Triosephosphat-Isomerase
Nur eines der Triose-phosphate wird in der Glycolyse weiterverarbeitet. Bei den beiden Triose-phosphaten GAP und DHAP handelt es sich aber um zwei unterschiedliche Stoffe. Da sie aber wie G6P und
F6P Keto-Aldol-Isomere darstellen, können sie von der Triosephosphat-Isomerase (TIM) zu GAP isomerisiert werden. Damit ist der vorbereitende Teil der Glycolyse abgeschlossen.
Zusammenfassend Reaktion 1-5:
Hexose Glucose › 2 Triose-phosphaten GAP umgewandelt
Dabei wurden zwei Moleküle ATP verbraucht. Reaktion 6: Glycerinaldehyd-3-phosphat-Dehydrogenase
In der sechsten Reaktion, vermittelt durch die Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH) wird das erste mal ein Produkt mit hohem Gruppenübertragungspotential gebildet. Zunächst wird
GAP mittels NAD+ oxidiert. Die dabei frei werdende Energie wird genutzt, um ein anorganisches Phosphat an GAP zu binden. Es entsteht 1,3-Bisphosphoglycerat (1,3-BPG). Reaktion 7: Phosphoglycerat-Kinase
Die siebte Reaktion dient endlich der ATP Gewinnung. Mittels einer Substratkettenphosphorylierung durch das Enzym Phosphoglycerat-Kinase (PGK) wird eine Phosphorylgruppe von 1,3-BPG auf ADP übertragen.
Es entstehen 3-Phosphoglycerat (3PG) und ATP. Die Reaktionsgleichung lautet somit: 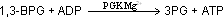
Reaktion 8: Phosphoglycerat-Mutase
Das 3-Phosphoglycerat wird in dieser Reaktion zu 2-Phosphoglycerat (2PG) umgewandelt. Das Enzym, welches diese Reaktion katalysiert, heißt Phosphoglycerat-Mutase (PGM). Sobald es sich bei einem
intramolekularen Umbau um mehr als die Verschiebung eines Hydrid-Ions handelt, spricht man nicht mehr von einer Isomerase, sondern von einer Mutase. In diesem Fall wird eine Phosphorylgruppe von C(3)
auf C(2) übertragen. Diese Reaktion wird benötigt, um in Reaktion 9 ein energiereiches Zwischenprodukt bilden zu können.
Reaktion 9: Enolase
Nun wird 2-Phosphoglycerat unter Katalyse durch das Enzym Enolase zu Phosphoglycerat (PEP) dehydratisiert. Voraussetzung ist wieder, wie schon so oft, die Anwesenheit eines zweiwertigen Kations wie
Mg2+ (oder auch Ca2+). Reaktion 10: Pyruvat-Kinase
In der letzten Reaktion der Glycolyse wird aus ADP ATP gewonnen, indem PEP zu Pyruvat hydrolysiert wird. Das beteiligte Enzym heißt Pyruvat-Kinase (PK).
Die Reaktionsgleichung lautet:
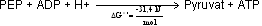
Aus der letzten Reaktion läßt sich auch der Sinn der Enolase Reaktion erklären. Während 2PG ein relativ energiearmes Molekül ist, beinhaltet PEP ein hohes Gruppenübertragungspotential.
Es ist sogar so hoch, dass nach der Substratkettenphosphorylierung weitere Energie als Wärme frei wird.
Gluconeogenese
Bez. für die enzymgesteuerte Neubldg. von Kohlenhydraten im Organismus durch Umkehr der Glykolyse, in einigen Reaktionsschritten jedoch von dieser abweichend (Genaueres u. Formelschema s.
dort). Die G. verbraucht chem. Energie in Form von Adenosin-5'-triphosphat. Sie dient der Aufrechterhaltung des Blutzucker-Spiegels bei Erschöpfung der Kohlenhydrat-Reserven u. bewirkt in
Leber u. Niere, in bestimmten Pflanzen u. in Mikroorganismen, die in Abwesenheit von D-Glucose wachsen, die Umwandlung von Brenztraubensäure (od. besser: Pyruvat), D- od. L-Milchsäure
(D- od. L-Lactat), Glycerin od. von bestimmten Aminosäuren zu D-Glucose od. Glykogen. D-Glucose wird einerseits zur Biosynth. von Glykokonjugaten u. strukturellen Polysacchariden, andererseits
als Brennstoff für Gehirnzellen u. Erythrocyten benötigt. In den letztgenannten Zellen, die ihren Energiebedarf ganz, u. in Muskelzellen, die ihn zeitweise nur aus der Glykolyse abdecken,
fällt Lactat als Stoffwechselprodukt an, das in der Leber gluconeogenetisch wieder abgebaut wird. Auf ähnliche Weise wird nach Phosphorylierung Glycerin, das in Fettzellen bei Verbrauch
der Reservefette entsteht, u. nach oxidativer Desaminierung L-Alanin, das in Muskelzellen aus Pyruvat u. Aminosäuren gebildet wird, durch die G. verwertet. Die Regulation der G. ist mit der
der Glykolyse verbunden u. soll dort besprochen werden. Reaktionswege, die in die Glycolyse münden
Außer Glucose gibt es weitere Kohlenhydrate, die durch die Glycolyse abgebaut werden können. Meist werden diese Alternativen zunächst zu Glucose oder zu einem Zwischenprodukt der
Glycolyse umgebaut und ab dann über den normalen Ablauf der Glycolyse verarbeitet. Bei diesen Alternativen handelt es sich um die Speicherpolysaccharide Stärke und Glycogen, um die Disaccharide
Maltose, Lactose, Trehalose und Saccharose und die Monosaccharide Fructose, Mannose und Galactose. Fructose
Fructose ist ein häufig vorkommender Monosaccharid, da sie den Zucker von Früchten und einen Bestandteil der Saccharose (des Rohrzuckers) darstellt.
Sie kann zwei Wege in die Glycolyse einschlagen, je nach Reaktionsort. In Muskeln und Nieren ist der Weg sehr einfach da sie hier wie auch die Glucose durch Hexokinase phosphoryliert werden
kann. Das entstandene Fructose-6-phosphat ist Bestandteil der Glycolyse.
In der Leber ist der Weg komplizierter.
- Zunächst wird die Fructose durch das Enzym Fructokinase zu Fructose-1-phosphat phosphoryliert.
- Fructose-1-phosphat wird durch Fructose-1-phosphat-Aldolase zu Glycerinaldehyd
und Dihydroxyacetonphosphat gespalten.
- Die beiden Produkte gehen verschiedene Wege
- Dihydroxyacetonphosphat wird durch TIM zu Glycerinaldehyd-3-phosphat umgewandelt
- Glycerinaldehyd wird durch Triose-Kinase ebenfalls zu Glycerinaldehyd-3-phosphat phosphoryliert.
- Ab hier greift wieder der normale Weg der Glycolyse
Galactose
Galactose entsteht bei der Hydrolyse der Lactose und ist ein C(4)-Epimer der Glucose.
- Sie wird zunächst durch Galacto-Kinase zu Galactose-1-phosphat phosphoryliert.
- Galactose-1-phosphat durchläuft dann eine Reihe von Reaktionen, bei denen UDP als Carrier für
einen Kreisprozeß wirkt.
- In diesem Kreislauf findet eine Epimerisierung statt.
- Zuletzt verläßt diesen Kreislauf Glucose-1-phosphat mit der Bindung eines neuen Moleküls Galactose-1-phosphat an UDP.
Mannose
Mannose ist Bestandteil verschiedener in der Nahrung enthaltener Polysaccharide und Glycoproteine.
- Mannose wird durch Hexokinase zu Mannose-6-phosphat phosphoryliert
- Mannose-6-phosphat wird durch Phosphomannoisomerase (Mannosephosphat-Isomerase) zu Fructose-6-phosphat umgewandelt
Disaccharide
Disaccharide können nicht direkt der Glycolyse zugeführt werden. Zunächst hydrolysieren Enzyme sie zu ihren Monosacchariden. Die Namen dieser Enzyme entsprechen denen der Disaccharide
lediglich mit der Endung –ase statt –ose.
Der Pentosephosphat-Cyclus
(PP-Weg, Phosphogluconat-Weg, Warburg-Dickens-Horecker-Weg)
Im Cytoplasma der Zellen ablaufende Reaktionskette des Kohlenhydrat-Stoffwechsels, durch deren sog. oxidativen Zweig unter Kohlendioxid-Eliminierung D-Ribulose-5-phosphat (ein Pentosephosphat,
daher Name) u. reduziertes Nicotinamid-Adenin-Dinucleotid-Phosphat (NADPH, oxidierte Form: NADP+) aus D-Glucose-6-phosphat gebildet werden. D-Ribulose-5-phosphat wird – nach Isomerisierung
zu D-Ribose-5-phosphat für die Biosynth. von Nucleotiden u. Nucleinsäuren, NADPH dagegen für reduktive Biosynth. benötigt; à Fettgewebe, Steroidsynthese.
Ist aufgrund der aktuellen Stoffwechsel-Situation der Bedarf an NADPH größer als der an Pentosephosphat, so können jeweils 6 Mol. des überschüssigen D-Ribulose-5-phosphat
zu 5 Mol. D-Glucose-6-phosphat rekombinieren. Dabei werden unter Einwirkung von Ribulosephosphat-3-epimerase, Transketolas u. Transaldolase verschiedene Zuckerphosphate als Zwischenstufen durchlaufen
(nichtoxidativer Zweig des PP-Wegs) u. außerdem Reaktionen der Gluconeogenese benutzt.
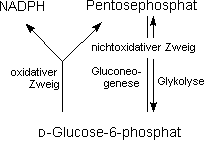
Bei 6maligem Durchlaufen dieses Zyklus wird 1 Mol. D-Glucose-6-phosphat vollständig zu Kohlendioxid u. anorg. Phosphat abgebaut. Nach neueren Arbeiten sollten in einigen Fällen an
dem nichtoxidativen Zweig des PP-Wegs nicht Transaldolase, dafür aber Fructosebisphosphat-Aldolase eine Arabinosephosphat-2-Epimerase u. eine Phosphatase beteiligt sein; diese Auffassungen
haben sich jedoch nicht allg. durchsetzen können . Bei hohen NADPH-Konz. wird Glucose-6-phosphat-Dehydrogenase u. somit der oxidative Zweig gehemmt. Ist dennoch Bedarf an Pentosephosphat
gegeben, so kann dieses über Reaktionen der Glykolyse sowie den nichtoxidativen Zweig des PP-Wegs synthetisiert werden.
Der Pentosephosphat-Cyclus ist ein alternativer Glucoseoxidationsweg zur Glycolyse. Er liefert statt des ATP eine andere Art energiereichen Stoffs, eine zweite “Energiewährung” der
Zellen, das NADPH. Seine Gesamtreaktion lautet:
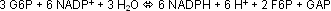
|
