Thermodynamik
(Wärmelehre), Teilgebiet der Physik, in dem das Verhalten physikalischer Systeme bei Zu- oder Abführung von Wärmeenergie und bei Temperaturänderungen untersucht wird. Grundlage
der Thermodynamik sind die Hauptsätze der Wärmelehre:
- Hauptsatz (Energieerhaltungssatz): Wärme ist eine bes. Form der Energie; sie kann in andere Energieformen umgewandelt werden und
umgekehrt. In einem abgeschlossenen System bleibt die Summe aller Energiearten (mechanische, thermische, elektrische, magnetische und chemische Energie) konstant
- Hauptsatz (Entropiesatz):
Die Energie eines abgeschlossenen thermodynamischen Systems kann sich nur durch Austausch mit der Umgebung ändern, oder sie kann sich nur von selbst vermehren.
Damit ist gleichzeitig der Richtungscharakter aller Wärmevorgänge ausgedrückt: Wärme kann nicht von selbst von einem kälteren auf einen wärmeren Körper übergehen.
- Hauptsatz (Nernstsches Wärmetheorem): Die Entropie eines festen oder flüssigen Körpers hat am absoluten Nullpunkt den Wert Null.
Entropie
Von R.J.E. Clausius eingeführte makroskopische Zustandsgröße aus der Thermodynamik. Die Entropie gibt den Teil der Wärmeenergie an, der nicht in mechanische Arbeit umgewandelt
werden kann. Es gibt umkehrbare (reversible) und nicht umkehrbare (irreversible) Prozesse. In abgeschlossenen Systemen bleibt die Entropie bei reversiblen Prozessen konstant, bei irreversiblen nimmt
sie stets zu. Prozesse, bei denen die Entropie zunimmt, laufen von selbst ab und können nur durch Aufwand von Energie rückgängig gemacht werden. Die Entropie ist also ein Maß für
die Umkehrbarkeit von Abläufen. Die Entropie (Formelzeichen S) läßt sich auf verschiedene Weise berechnen: makroskopisch - phänomenologisch: DS = DQ/T (Entropieänderung
ist zugeführte Wärmemenge durch absolute Temperatur) od. mikroskopisch - statistisch nach L. Boltzmann (1866) , wonach jedes System den Zustand größter Unordnung anstrebt (anschaulich:
vollständige Mischung zweier verschiedener Gase oder gleichmäßige Temperaturverteilung in Körpern). Enthalpie
Bezeichnung für den nicht meßbaren Energieinhalt eines chemischen Stoffes. Reaktions-Enthalpie (Reaktionswärme) ist die meßbare Differenz zwischen Enthalpie der Ausgangs-
und Endstoffe. Freie Enthalpie
Mit freier Enthalpie bezeichnet man die Energie, die ein frei zur Verfügung System hat, um beliebige Arbeiten zu verrichten. Pflanzen gewinnen diese Energie aus dem Sonnenlicht, der Rest aus
Nährstoffmolekülen. Bei einem geschlossenen System und auch in den in biologischen Systemen herrschenden Bedingungen (konstanter Druck und Temperatur) lassen sich freie Enthalpie, Enthalpie und Entropie in eine Gleichung
setzen.: (Anm.: Genaugenommen setzt man Differenzen in die Gleichung ein) ΔG = ΔH – T × ΔS
Legende:
- ΔG ist die Änderung der freien Enthalpie eines Systems
- ΔH ist die Änderung der Enthalpie eines Systems
- T ist die absolute Temperatur
- ΔS ist die Entropie eines Systems
Dabei drücken die einzelnen Variablen folgendes aus:
- Ist DH negativ, dann ist die Reaktion exotherm; ist DH positiv, ist die Reaktion endotherm
- Ist DS negativ, dann ist die Reaktion exergonisch, ist DS positiv, ist die Reaktion endergonisch
Wichtige Funktionelle Gruppen
Aminogruppe
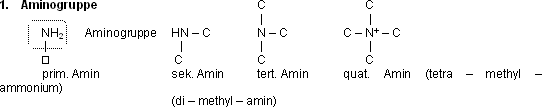
Thioalkohol
Säureamide

Thioester

Peroxide
cyclische Schwefelverbindungen
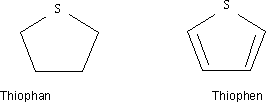
cyclische Stickstoffverbindungen
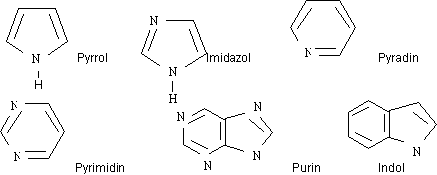
Carbonsäuren
Monocarbonsäuren |
Dicarbonsäuren |
ungesättigte Carbonsäuren |
Ameisensäure Essigsäure Propionsäure
Buttersäure
Valeriansäure Kapronsäure |
Oxalsäure Malonsäure
Bernsteinsäure (Succinate) Glutarsäure
Adipinsäure |
Fumarsäure trans
Maleinsäure cis |
Doppelbindungen
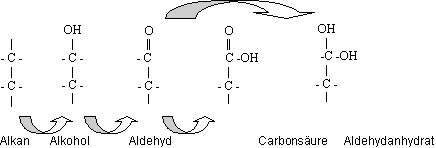
Reaktionen von Alkoholen | Aldehyden | Carbonsäuren
- Alkohol + Alkohol › Ether + Wasser C – O – C
- Aldehydhydrat + Alkohol › Halbacetal + Wasser CHOH – O – C
- Carbonsäure + Alkohol › Ester + Wasser C – CO – O – C
- Aldehydhydrat + Aldehydhydrat › unwichtig
- Carbonsäure + Aldehydhydrat › unwichtig O O
- Carbonsäure + Carbonsäure › Säureanhydrid + Wasser C – O – C
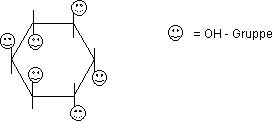
OH – Gruppen
Alkoholische
Unterscheidung in Primäre ›> oxidieren / dehydrieren › Aldehyde
Sekundäre › oxidieren / dehydrieren › Ketone
Tertiäre › Oxidation nicht ohne Zerstörung des Moleküls möglich,
Reaktionsfreudigkeit: gering
Alkoholische im Cycloalkan
Halbacetalische
Reaktionsfreudigkeit: gut, wirken reduzierend
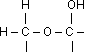
Phenolische
Reaktionsfreudigkeit: gut, reagieren sauer, da sie zur Dissoziation neigen
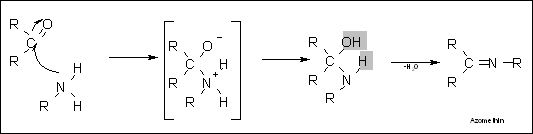
Schiff-Base, Schiff'sche Base
Schiff’sche Basen, auch Azomethin genannt, entstehen bei der Reaktion eines primären Amins mit einem Aldehyd oder einem Keton. Die Einzelschritte
sind folgende:
- Das Amin greift am Carbonyl-C-Atom an und bildet ein Zwischenprodukt.
- Dabei wird ein Proton vom Stickstoff zum Sauerstoffatom “übertragen”.
- Das Zwischenprodukt eliminiert Wasser, indem es vom Stickstoff ein H-Atom und die neue –OH Gruppe abspaltet.
essentielle Nahrungsmittel sind :
- Aminosäuren
- Vitamine
- Mineralstoffe
- Fettsäuren
- Elemente (O2)
- Wasser
Definition: Essentielle Nahrungsbestandteile sind Stoffe, die der Körper nicht selbst synthetisieren kann, aber benötigt und daher von außen zufügen muß.
|
