Allgemeines zu Kohlenhydraten
- sind die in der Natur am häufigsten vorkommenden Biomoleküle
- dienen Zellen als wichtigster Energielieferant
- sind praktisch in jeder Nahrung vorhanden
- drei Gruppen der Kohlenhydrate:
- Mono-,
- Oligo- und
- Polysaccharide.
- Monosaccharide sind Einfachzucker, also die kleinste Einheit der Kohlenhydrate. Ihr prominentester Vertreter ist die D-Glucose.
Oligosaccharide sind Ketten mit bis zu zehn Monosacchariden. Davon kommen jedoch am häufigsten die sog. Disaccharide, Verknüpfungen von zwei Einfachzuckern vor.
Polysaccharide haben zuletzt bis zu mehreren tausend Monosaccharide, welche zu verzweigten und unverzweigten Ketten verknüpft sind
Sammelbez. für die als Naturstoffe sehr verbreiteten Polyhydroxyaldehyde (Aldosen) u. Polyhydroxyketone (Ketosen) sowie höhermol. Verb., die sich durch Hydrolyse in solche Verb. überführen
lassen.
K. haben meist die
Bruttoformel CnH2nOn od. Cn(H2O)n
u. lassen sich somit formal als „Hydrate des Kohlenstoffs“ auffassen, was K. Schmidt 1844 veranlaßte, diese Verb. „K.“ zu nennen. Andererseits existieren zahlreiche Verb.,
wie Essigsäure u. Milchsäure, die wesentlich andere Eig. als die zu den K. gerechneten Verb. besitzen. Die monomeren Polyhydroxyaldehyde od. Polyhydroxyketone nennt man Monosaccharide, ihre
Dimeren bis Decameren Oligosaccharide (Disaccharide, Trisaccharide usw.) u. die makromol. K. Polysaccharide. Häufig werden die Mono- u. Oligosaccharide als „Zucker“ zusammengefaßt
u. den Polysacchariden gegenübergestellt. Dies hat eine gewisse Berechtigung, denn die niedermol. K. sind süßschmeckende, wasserlösl., meist krist. Verb. von definierten MG., während
die Polysaccharide wie die meisten Polymeren kein einheitliches MG. haben, sich außerdem in Wasser nur schlecht od. gar nicht lösen u. prakt. geschmacksfrei sind.
Bei den Monosacchariden (auch „einfache Zucker“ genannt) versteht man in der dtsch.-sprachigen Lit. unter Biosen, Triosen, Tetraosen, Pentosen, Hexosen, Heptosen (genauer: Aldotriosen...
bzw. Ketotriosen...) solche Verb., die 2, 3, 4 etc. Sauerstoff-Funktionen enthalten. Nach den vorläufigen IUPAC-Regeln für die K.-Nomenklatur leiten sich die gleichen Benennungen von der Anzahl
der im Mol. vorhandenen Kohlenstoff-Atome ab. In Natur u. Technik spielen die Biosen, Triosen, Tetrosen u. Heptosen außer als Intermediärprod. in manchen Stoffwechselreaktionen keine Rolle,
wohl aber die Pentosen u. Hexosen.
Wichtige Aldopentosen sind z.B. D-Ribose, D-Xylose u. L-Arabinose.
Zu den wichtigsten Aldohexosen gehören D-Glucose, D-Mannose u. D-Galactose
Bei den Ketohexosen sind v.a. D-Fructose u. Sorbose zu nennen.
Die 6-Desoxyzucker L-Fucose u. L-Rhamnose sind ebenfalls weit verbreitete Hexosen. Die Kohlenstoff-Kette der meisten bekannten Monosaccharide ist unverzweigt, doch besitzen manche pharmakolog. bedeutsame
Naturstoffe, insbes. Antibiotika, nicht nur Anteile von verzweigten Zuckern (Beisp.: Apiose, Hamamelose, Streptose), sondern auch von 6-Desoxy-, Amino- sowie Hydroxy-aminozuckern. D-Glucosamin ist in
der Natur weit verbreitet als Bestandteil z.B. von Chitin, Mucopolysacchariden u. Blutgruppensubstanzen. Die Monosaccharide zeigen folgende gemeinsame Reaktionen:
- Kupfer-, Silber- u. Wismut-Salze werden in Lsg. reduziert.
- Mit Basen reagieren die Monosaccharide unter Bldg. von Saccharaten (Alkoholaten), mit konz. Laugen unter Verharzung; hierbei
entstehen gelbe u. dunkle Prod.
- Keine Reaktion mit Hydrogensulfiten od. Fuchsin/Schwefliger Säure, da bei den Aldosen die Aldehyd-Gruppe maskiert ist.
- Bei der Red. erhält man mehrwertige Alkohole.
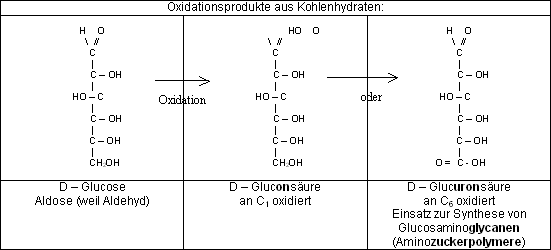
- Bei der Oxid. entstehen Mono- u. Dicarbonsäuren (Zuckersäuren).
- Die Alkohol-Gruppen können mit Säuren verestert werden.
- Blausäure wird addiert.
- Mit Phenylhydrazin entstehen Osazone.
Ganz allg. kann man jedoch sagen, dass die K.-Chemie ihre eigenen Gesetze hat, d.h. dass viele Reaktionen einen anderen als den gewohnten Verlauf nehmen, was wohl auf die Anwesenheit der
vielen Hydroxy-Gruppen, z.T. wohl auch auf die Ring-Ketten-Tautomerie zurückzuführen ist. Diese u.a. Eig. sind auch für die Auswahl der Trennverf. in der Analytik der K. maßgebend.
Als sehr nützlich haben sich die Dünnschichtchromatographie u. die HPLC erwiesen , nach Derivatisierung lassen sich gaschromatograph. furanoside von pyranosiden Formen u. Enantiomere voneinander
trennen . Zur Identifizierung kann man sich der Reaktion mit Boranen bedienen . Die Krist.-Strukturen von K. werden regelmäßig in der Serie Adv. Carbohydr. Chem. referiert.
Nach Emil Fischer steht bei senkrechter Schreibweise der Projektionsformeln (Fischer-Projektion) die Aldehyd-Gruppe der Aldosen oben, bei waagerechter rechts. Das Zählen der Kohlenstoff-Atome erfolgt
dabei so, dass bei den Aldosen dem C-Atom der Aldehyd-Gruppe die Nummer 1, bei den Ketosen der Keto-Gruppe die niedrigste Ziffer zugeordnet wird.
Da in den Mol. eine Reihe von asymmetr. C-Atomen auftritt, ist auch eine Reihe von unterschiedlichen Stereoisomeren möglich, wenn man die Form mit offener Kette zugrunde legt u. jeweils beide Antipoden
berücksichtigt. Die Konfiguration der K. wird durch die vorangestellten Buchstaben D- bzw. L- ausgedrückt; diese beziehen sich auf die Reihe, der der betreffende Zucker angehört, u. nicht
auf seinen Drehsinn; die Buchstaben wurden früher willkürlich dem einfachsten K. (d.h. seinen Enantiomeren) zuerteilt: Als Bezugssubstanzen dienten dabei der rechts- u. der linksdrehende Glycerinaldehyd,
von denen sich alle Zucker ableiten lassen; Näheres s. dort u. Abb. bei Konfiguration u. Enantiomerie. So werden z.B. Fructose u. Mannose als Glieder der D-Reihe als D-Fructose u. D-Mannose bezeichnet.
Der Drehsinn wird – falls erforderlich – durch Plus- (für rechtsdrehend) bzw. Minuszeichen (für linksdrehend) ausgedrückt [Beisp.: D-(–)-Fructose]. Man ordnet eine Aldose
der D-Reihe zu, wenn bei dem am weitesten von der Aldehyd-Gruppe entfernten asymmetr. C-Atom in der Projektionsformel die Hydroxy-Gruppe rechts, das H-Atom links steht (wie beim D-Glycerinaldehyd).
Das wiedergegebene abstrakte Schema der relativen Konfigurationen von Tri-, Tetr-, Pent- u. Hexosen, in dem die horizontalen Striche die OH-Gruppen symbolisieren sollen u. A u. B org. Reste sind, gibt
ausschließlich Vertreter der D-Reihe wieder; Beisp.: D-galacto-Hexose = D-Galactose. Obwohl sich die meisten Reaktionen der Monosaccharide an Hand der offenkettigen Struktur erklären lassen,
setzen doch einige Reaktionen (wie das Ausbleiben der Farbreaktion mit Fuchsin/Schwefliger Säure u. die Bldg. der Glykoside) die Existenz einer Halbacetal-Form voraus, die durch die Reaktion der
Carbonyl-Gruppe mit einer Hydroxy-Gruppe des eigenen Mol. entsteht.
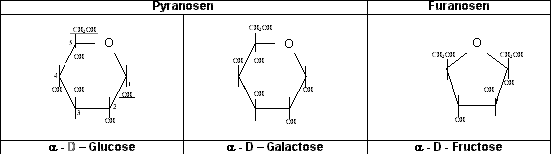
Bei den Aldohexosen kann der Ringschluß mit den Hydroxy-Gruppen an den C-Atomen 4, 5 od. 6 erfolgen. Im ersten Fall entsteht eine Furanose, im 2. Fall eine Pyranose u. im 3. Fall eine Septanose.
Wenn erforderlich, sollen nach den Richtlinien der IUPAC die furanosiden u. pyranosiden Formen durch die Suffixe f bzw. p gekennzeichnet werden. Bei der Ringbldg. wird auch das C-Atom der Pos. 1 asymmetr.,
wodurch die mögliche Anzahl der opt. Isomeren nochmals verdoppelt wird. Dieses neue asymmetr. C-Atom ist ein sog. anomeres C-Atom, u. das Monosaccharid wird jeweils als a- od. b-Form – je
nach der Konfiguration des anomeren C-Atoms – bezeichnet. Die oben abgebildete cycl. Form wäre demnach als a-D-Glucopyranose u. unter Verw. der in der K.-Chemie üblichen Dreibuchstaben-Kurzbez.
als a-D-Glcp zu bezeichnen . Die über eine Ringöffnung verlaufende Epimerisierung ist auch der Grund für das Auftreten von Mutarotation; zur Best. des Carbonyl-Anteils in wäss. Zuckerlsg.
läßt sich die 13C-NMR-Spektroskopie heranziehen . Natürlich sind die Ringstrukturen der K. nicht eben, sondern haben Sessel- od. Wannenform, wobei die erste Form bevorzugt ist. In den
Oligosacchariden sind 2–10 Monosaccharid-Mol. unter Wasseraustritt zu größeren Mol. vereinigt, die sich als Glykoside od. Ether auffassen lassen . Die einfachsten Oligosaccharide sind
die Disaccharide, von denen drei frei vorkommen, die von großer Bedeutung sind, nämlich Saccharose (Rohrzucker, Rübenzucker), Lactose (Milchzucker) u. Maltose (Malzzucker). Nach Pflumm
können Fliegen zwischen verschiedenen Oligosacchariden unterscheiden. Die Disaccharide sind häufig Bestandteile von Glykosiden (Beisp.: Gentiobiose des Amygdalins); von bes. Bedeutung sind
Maltose u. Cellobiose, die bei der Hydrolyse von Stärke bzw. Cellulose entstehen (die Maltose kommt auch frei vor). Die Bindung zwischen den Monosacchariden ist O-glykosidisch (Ether), doch kann
daran nur eine der beiden Halbacetal-Hydroxy-Gruppen beteiligt sein. Tatsächlich besitzen viele Disaccharide (z.B. die Maltose) reduzierende Eig. wie die Monosaccharide, was bedeutet, dass einer
der Zuckerreste Halbacetal-Form besitzt. Sind die beiden Monosaccharide jedoch über ihre anomeren C-Atome, d.h. die glykosid. Hydroxy-Gruppen, gekoppelt (z.B. im Rohrzucker), so ähnelt das
Disaccharid einem Acetal, wirkt deshalb nicht reduzierend u. bildet auch kein Phenylosazon od. ein anderes Carbonyl-Deriv. Analog den Disacchariden sind auch die übrigen Oligosaccharide aufgebaut.
Die Unters. von K. wird durch die Vielzahl etwa gleich reaktiver Hydroxy-Gruppen u. durch die große Zahl möglicher Strukturen erschwert. Daher müssen bei Synth. die Hydroxy-Gruppen durch
Schutzgruppen möglichst selektiv blockierbar sein.
Die Polysaccharide lassen sich in zwei Gruppen gliedern, nämlich in die als Gerüststoffe für Pflanzen u. einige Tiere dienenden Polysaccharide u. in die Reservestoffe für einfachere
K., die bei Bedarf im Organismus durch bestimmte Enzyme in Freiheit gesetzt werden. Beide Gruppen sind hochmol. Polymere, die oft nur aus einer einzigen Pentose od. Hexose aufgebaut sind. Im Gegensatz
zu solchen Homoglykanen (Beisp.: Cellulose, Stärke, Glykogen) sind die Heteroglykane aus verschiedenartigen Monosacchariden aufgebaut (Beisp.: Holz-Polyosen, Mucopolysaccharide wie Hyaluronsäure).
Einige Grundzüge der Polysaccharid-Nomenklatur sind in Lit. niedergelegt. In Polysacchariden, die bevorzugt als Verdickungsmittel in der Lebensmittel-Technologie dienen, finden sich außer
Pentosen u. Hexosen auch Methylpentosen, Uronsäuren u. Zuckersulfate (Alginsäuren, Carrageen).
Die K. spielen in der Natur eine vielfältige Rolle. Sie werden von den Pflanzen in ungeheueren Mengen durch Photosynth. produziert (Biomasse – Cellulose ist die mengenmäßig bedeutendste
org. Verb.), u. zwar als Gerüstsubstanzen (Cellulose im Holz) od. als Speicherstoffe (Stärke, Saccharose u.a. Zucker). Daneben werden sie auch im tierischen Organismus nicht nur als Reservestoff
(Glykogen) benötigt, sondern sind unentbehrlich als Bestandteile der Nucleinsäuren, der Glykolipide, Glykoproteine, Glykosphingoside u. dgl. – in der Immunologie schreibt man den K.-Anteilen
wichtige Erkennungs-Funktionen bei Antigen-Antikörper-Reaktionen zu . Manche Erbkrankheiten sind mit – durch enzymatische Analyse aufspürbaren – K.-Stoffwechseldefekten verbunden.
Die Entstehungsweise der Oligo- u. Polysaccharide ist insbes. von Leloir untersucht u. aufgeklärt worden. Schlüsselsubstanzen der K.-Biosynth. sind die Zuckernucleotide, d.h. aus Pyrimidin-
bzw. Purinbase, Ribose, Phosphorsäure u. einem Saccharid bestehende Überträger-Mol. Der erste, 1948 von Leloir entdeckte „aktivierte Zucker“ dieses Typs war die Uridindiphosphat-Glucose
(UDPG). Schon viel länger sind die Abbauwege der K. bekannt, insbes. die der Monosaccharide (Glykolyse) u. der Speicherstoffe wie Glykogen. Sowohl Auf- wie Abbau gehen unter dem Einfluß von
Enzymen vonstatten. Die im K.-Stoffwechsel gebildeten Brenztraubensäure-Fragmente werden im Organismus teilw. zur Synth. der Fette ausgenutzt, was bei Fehlernährung einerseits zu Fettsucht,
andererseits zur Überhöhung der Blutfettwerte u. damit zur Arteriosklerose-Disposition führen kann. Allerdings haben sich manche Vermutungen über Zusammenhänge zwischen K.-Aufnahme
u. Morbidität als irrig erwiesen . Gesichert scheint jedoch die Relation zwischen dem Auftreten von Karies u. unphysiolog. hohem Verbrauch an Zucker. Monosaccharide und Disaccharide
- bestehen aus einem Kohlenstoffgerüst
- die C-Atome sind untereinander mit Einfachbindungen verknüpft
- an fast jedem C-Atom ist eine Hydrid- und eine Hydroxy-Gruppe gebunden
- durch dieArt des Aufbaus ergeben sich bei den C-Atomen oftmals Möglichkeiten der Chiralität
› wachsende Zahl verschiedener Zucker bei wachsender Kettenlänge
- Summenformel Kohlenhydrate [ Cn (H2O)n] Eselsbrücke
- Polyhydroxyaldehyde / - ketone.
Klassifizierung

Die Familien der Monosaccharide
Aus der o.g. Summenformel ergibt sich, dass unter Berücksichtigung der End-C-Atome die Zahl der Hydrid- und Hydroxy-Gruppen nicht für alle Kohlenstoffe ausreichen.
Folglich: Unterschied in dieser Gleichmäßigkeit.
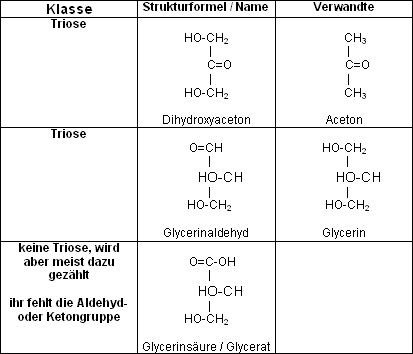
Unterscheidung nach Ausbildung einer Aldehyd oder Ketogruppe
› C geht Doppelbindung mit einem Sauerstoffatom ein
Je nach Position entsteht dabei eine Aldehyd- oder Ketoverbindung, also eine Aldose oder eine Ketose.
Die einfachsten Vertreter beider Richtungen sind Glycerinaldehyd und Dihydroxyaceton. 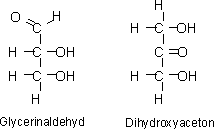
Die Namengebung der Einfachzucker verläuft später konsequent. Von Glycerinaldehyd abstammende Zucker bekommen die Endung –ose. Beispiele hierfür sind Ribose, Glucose, usw.
Bei Abkömmlingen des Dihydroxyacetons nimmt man den Namen des analogen Aldehyd Zuckers und setzt die Silbe –ul vor –ose. So heißt das Analogon zu Ribose dann Ribulose. Bei
diesem System gibt es nur wenige Ausnahmen, wie den Keto-Zucker Fructose.
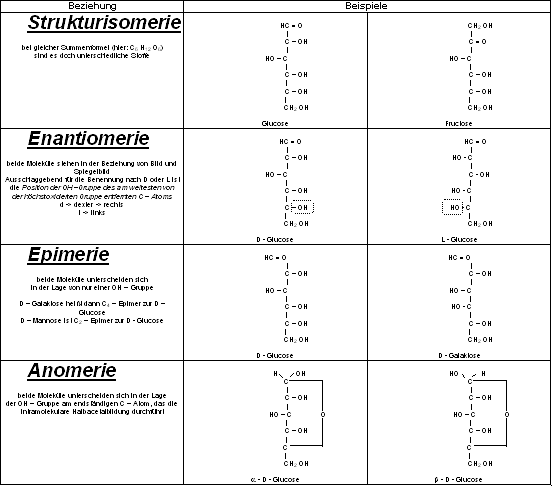
Unterscheidung in D und L Zucker
- alle Monosaccharide haben ein oder mehrere chirale Zentren
- Ausnahme: Dihydroxyaceton
- Anzahl der Chiralitätszentren = der Anzahl der Kohlenstoffatome –2
- mögliche Enantiomere = 2n, bei n gleich der Anzahl chiraler Zentren
- erste Unterscheidung: Glyceraldehyd statt
ein chirales C-Atom ermöglicht zwei Enantiomere
D-Glyceraldehyd + L-Glyceraldehyd, je nach Ausrichtung in der Fischer Projektion.
- In der weiteren Abfolge größerer Zucker werden jeweils die untersten chiralen C-Atome herangezogen
- unterscheiden sich zwei Zucker nur durch die Ausrichtung eines einzelnen
chiralen Zentrums:
› Epimere
Pentosen
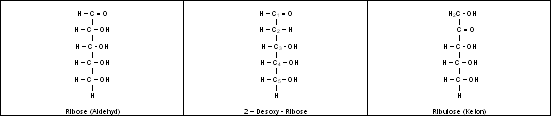
Hexosen
Hexosen in der Halbacetalform
Die in der Natur vorkommenden 5er und 6er Zucker liegen normalerweise nicht in der oben besprochenen Kettenform vor. Statt dessen hat ein Ringschluß stattgefunden. So sind aus 5er Zuckern
Furanosen und aus den 6er Zuckern Pyranosen entstanden. Diese Namen sind von den einfachsten 5er und 6er Ringen, an denen fast nur Kohlenstoff und Wasserstoffatome beteiligt sind, nämlich Furan
und Pyran abgeleitet.
Der Ringschluß der Zucker läuft über einen Prozeß ab, der allgemein der Halbacetabildung entspricht.
Dabei geht der Sauerstoff der Hydroxy-Gruppe des vorletzten Kohlenstoffs eine Verbindung mit dem ersten Kohlenstoffatom ein. Dabei wird das Hydrid-Ion der Hydroxy-Gruppe abgespalten und ein anderes
Hydrid-Ion an den vormals doppelt gebundenen Sauerstoff der Aldehydgruppe angelagert.
Ringdarstellung
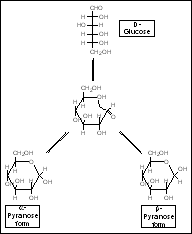
Das O befindet sich immer rechts oben, das im folgende C-Atom im Uhrzeigersinn ist C1.
Alle sich rechts befindlichen OH-Gruppen stehen nun unten, alle linken demzufolge oben.
C6 steht bei der D – Reihe also immer oberhalb von C5, bei der L – Reihe unterhalb von C5.
Steht die OH – Gruppe von C1 unten, handelt es sich um ein a - Molekül, für ein b - Molekül stünde sie oben.
Grundformen:

Ringform der Zucker
 zwei Zucker unterscheiden sichnur durch die Rotation der Aldehydgruppe zwei Zucker unterscheiden sichnur durch die Rotation der Aldehydgruppe
› a und b Formen, man spricht von Anomeren
- Zusammenschluß zu 5er Ringen ähnlich zu der gezeigter Reaktion
- 6er Zucker können auch einen 5er Ring bilden
- sterische Kräfte jedoch größer als in einem 6er Ring
› größere Ringe wesentlich häufiger
Begriffe:
Homoglycane: Polymere aus einem Monosaccharid
Heteroglycane: Polymere aus versch. Monosacchariden › Glycosaminglucane
Cellulose: pflanzl. Polysaccharid, β 1-4 Bindungen mit β 1-6 Verzweigungen
Dextrine: Glucose, β 1-4 Bindungen, nicht abbaubar
Glycogen: tierisch, α 1-4 glucosilische Bindungen, α 1-6 Verzweigungen
Abkürzungen für häufige Monosaccharide und ihre Derivate
Abequose
Arabinose
Fructose
Fucose
Galactose
Glucose
Mannose
Rhamnose
Ribose
Xylose |
Abe
Ara
Frau
Fuc
Gal
Glc
Man
Rha
Rib
Xyl |
Gluconsäure
Glucuronsäure
Galactosamin
Glucosamin
N-Acetylgalactosamin
N-Acetylglucosamin
Muraminsäure
N-Acetylmuraminsäure
N-Acetylneuraminsäure
(Sialinsäure) |
GlcA
GlcUA
GalN
GlcN
GalNAc
GlcNAc
Mur
MurNAc
NeuNAc |
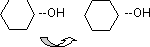
Bildung von Disacchariden - glykosidische Bindung
- Disaccharide werden aus zwei Monosacchariden gebildet
- Bindung des Atoms C1 des einen Zuckers (Anomeres C-Atom) mit OHydroxy-Gruppe des anderen
› Bildung eines Acetals aus einem Halbacetal und einem Alkohol
› hydrolystischer Prozeß
- anomeres Kohlenstoffatom des einen Zuckers mit einem Sauerstoffatom verbunden
› O-glykosidischen Bindung
- Gegensatz dazu:
› N-glykosidische Bindung: anomeres Kohlenstoff mit N verbunden (bei allen Nucleotiden)
- bei Bildung einer längeren Kette: Ende mit nicht gebundenem anomeren Kohlenstoff
= reduzierendes Ende
Vollacetalbildung (analog Vollketalbildung)


Halbacetalische (beide Halbacetal – OH – Gruppen reagieren miteinander)
Disaccharid
Glucose + Glucose = Trehalose
wirken nicht reduzierend, weil keine HA-OH mehr da ist
Halbacetalische (Halbacetal – OH – Gruppe mit einer beliebigen OH – Gruppe des Halbacetals)
Polysaccharid
Glucose + Glucose + Glucose + ... = Maltose
wirkt immer wieder reduzierend
Bildung von Maltose (Malzzucker)
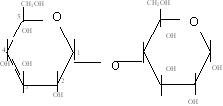
α - 1,4 – Glycosilische Bindung
› kann zum Polysaccharid werden
α - D – Glucopyranosido – 1,4 - a - D – Glucopyronose
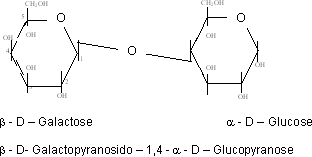
Bildung von Lactose (Milchzucker)
Bildung von Saccharose (Rohrzucker, Rübenzucker)
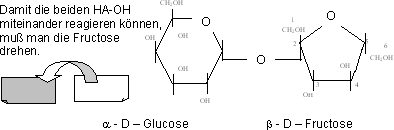
α - D – Glucopyranosido – 1,2 - β - D – Fructofuraosid
Reaktionen mit NH – Gruppen (N - Glycosilisch)
nur in Nucleinsäuren
es reagieren immer β - Ribose und eine Base
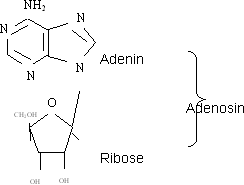
Nomenklatursystem
- Beschreibung von Mehrfachzuckern
- wichtigste Konvention ist dabei die Nennung der verbindenden Kohlenstoffatome
- Beispiel:
erster Zucker durch sein erstes Kohlenstoffatom an einen zweiten Zucker durch dessen viertes Kohlenstoffatom gebunden, dann werden beide Zucker genannt und zwischen ihre Namen die Art der Bindung,
hier (1 › 4), geschrieben. Diese Kennung ist deshalbt so wichtig, da davon auch Enzymnamen abgeleitet werden. Oftmals wird auch noch die Rotationsstellung des anomeren Kohlenstoffs, als a
und b, genannt. Um die Länge der Stoffnamen abzukürzen hat man sich bei den Kohlenhydraten ein ähnliches System wie bei Aminosäuren ausgedacht. Auch hier werden die Trivialnamen häufiger
Kohlenhydrate über ein drei Buchstaben System abgekürzt.
Polysaccharide
- langkettige Polymere von Monosacchariden mit hoher Masse
- je nach Aufbau: Unterscheidung von
unverzweigte und verzweigte Polysaccharide
Homopolysaccharide: nur einem Typ Monosaccharid
Heteropolysaccharide: unterschiedliche Monosaccharide
- Kettenlänge und somit das Gewicht nicht genau festgelegt ›unterschiedliche Synthesewege
- bei Polysacchariden ist ein komplexes System aufbauender Enzyme tätig
- es werden ähnlich einer Fließbandarbeit nacheinander Bindungen verknüpft
- das aber nur dann, wenn alle anderen Vorbedingungen und Vorarbeiten erfüllt
- es ergibt sich eine genau definierte Abfolge von Monosacchariden innerhalb der Kette
- Länge und damit das Entwicklungsstadium des Polysaccharids ist jedoch nicht festgelegt
Beispiel Glycogen
- Polysaccharid, welches als Energiespeicher benutzt
- bis zu 7% des Gewichts der menschlichen Leber
- Bestandteil lediglich Glucose, ist also ein Homopolysaccharid.
- Glucoseeinheiten sind in Glycogen zunächst über (a1›4) Bindungen verknüpft
- alle 8 bis 12 Reste eine Verzweigung zu einer Seitenkette auf, eine (a1›6)
Bindung
- zur Energiegewinnung werden jeweils einzelne Glucose Monomere abgespalten
- dies kann an allen Seitenkettenenden geschehen
› Form der Energiegewinnung sehr schnell
- Glycogen liegt in der Leber in Granula Form vor
- Granula enthalten alle Enzyme zur Spaltung des Glycogens, müssen also nur noch aktiviert werden
- Sinn der Glucosespeicherung in Form des Glycogens:
› Glycogen anders als Glucose nicht wasserlöslich
› nicht osmotisch aktiv ist
› Eisparung für Zellen bei der Aufrechterhaltung des osmotischen Drucks
Makromolekülform des Polysaccharids:
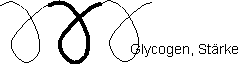
eine Schleife enthält 6 Glucose – Moleküle
diese Struktur ist gut abbaubar im Körper
Macht man die selbe Reaktion mit b - Glucose entsteht Zellulose. Deren Struktur ist gerade, sie ist im Körper nicht abbaubar. Dafür eignet sie sich aufgrund ihrer Struktur hervorragend
zum Abstützen von Pflanzen.
Glycogen und Stärke
Beide Polysaccharide stellen Speicherformen der Glucose dar. Sie bestehen aus langen, verzweigten Ketten, die durch (a1à4)-glykosidische Bindungen in der Kette bzw. (a1à6)-glykosidische
Bindungen an den Verzweigungen verbunden sind.
- In tierischem Gewebe wird Glycogen durch das Enzym Glycogen-Phosphorylase, in Pflanzen Stärke durch das Enzym Stärke-Phosphorylase gespalten. Die Spaltreaktionen finden an den
nichtredzierenden Enden der Ketten statt, wodurch jeweils a-D-Glucose-1-phosphat entsteht. Solche Spaltungen werden bis zu einer Stelle, die noch vier Reste von einer 1à6 Bindung entfernt
ist, durchgeführt.
- Danach muß erst ein sog. Debranching-Enzym wirken, dass drei der Reste an einen anderen Teil der Kette anhängt.
- Die einzelne, (a1à6)-glykosidisch gebundene Glucose
wird extra als einfacher Monomer von eben genanntem Debranching-Enzym abgespalten.
- Bis auf das eine Glucosemolekül ist bisher nur Glucose-1-phosphat entstanden. Dieses wird von dem
Enzym Phosphoglucomutase zu Glucose-6-phosphat umgewandelt. Es sind somit nur Ausgangs- und Zwischenprodukte der Glycolyse entstanden.
Glucosaminoglykane und Proteoglykane
Der extrazelluläre Raum wird durch lange Polysaccharidfasern erfüllt, welche man allgemein als extrazelluläre Matrix zusammenfaßt. Fasern, welche den Namen Glucosaminoglykane
(GAG) tragen, geben den Zellen Halt und ermöglichen gleichzeitig die für den Stoffwechsel wichtige Diffusion. Sie bilden eine klare, viskose, gallertartige Masse, welche in Gelenken
als Synovialschmiere eingesetzt wird und dem Glaskörper des Auges seine Konsistenz gibt. Allgemein sind sie Heteropolysaccharide, welche aus einer langen Kette von sich wiederholenden Disacchariden
aufgebaut sind. Einer der Monosaccharide ist dabei immer N-Acetylglucosamin oder N-Acetylgalactosamin, der andere eine Uronsäure, häufig Glucuronsäure.
In der Matrix bilden Glucosaminoglykane häufig langgestreckte Fasern, welche an extrazelluläre Proteine gebunden sind und mit ihnen sog. Proteoglykane bilden. In diesen riesigen Aggregaten
stellen die Polysaccharide einen Anteil von 95%.
Glycoproteine
ten der GAGs gibt es auch Verbindungen von Proteinen mit kurzen Oligosacchariden. Glycoproteine kommen sehr häufig in Zellmembranen vor und stellen den größten
Teil der in eukaryontischen sezernierten Proteine dar.
Die Verbindung einer oder mehrerer Oligosaccharide mit einem Protein kann verschiedene Gründe haben. Einmal werden Proteine wesentlich wasserlöslicher. Wichtig ist auch, dass die
Kohlenhydrate auf die Tertiärstruktur eines Proteins durch ihre Polarität einen großen Einfluß haben und damit auch Strukturinformationen darstellen. Außerdem kann
ein Protein durch diese polare Barriere vor Enzymen geschützt werden, welche sonst eine Reaktion des Proteins katalysieren.
Man hat herausgefunden, dass Oligosaccharide, welche an Proteine geheftet werden, ebenfalls eine Signalwirkung haben. So stellen sie in Membranlipiden einen möglichen Erkennungscode
dar. Oder sie dienen innerhalb der Zelle als Indikator für den Bestimmungsort des Proteins, wie z.B. die Zellmembran, ein bestimmtes Organell, die Ausschleusung aus der Zelle. Aminozuckergrundmolekül:

aktivierte Glucose:
Vorgehensweise:
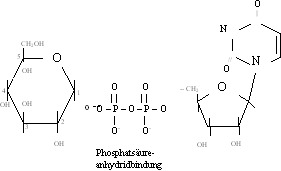 An C1 von Glucose wird ein Phosphatrest an die Halbacetalgruppe angehängt (Glucose-1-Phosphat). Der andere Reaktionspartner, Uridin, besteht aus dem Pyrimidinderivat (Cycloamid) Uracil
und der Ribose. Er liegt als Uridintriphosphat in einem Gleichgewicht vor. In der Lösung gibt es nun also neben Uridintriphosphat (UTP) auch dessen Edukte Uridinmonophosphat (UMP) und Pyrophosphat.
In der Zelle aber wird Pyrophosphat zersetzt und damit aus dem Gleichgewicht entfernt. à die Spaltung von UTP in UMP und Pyrophosphat ist irreversibel. An C1 von Glucose wird ein Phosphatrest an die Halbacetalgruppe angehängt (Glucose-1-Phosphat). Der andere Reaktionspartner, Uridin, besteht aus dem Pyrimidinderivat (Cycloamid) Uracil
und der Ribose. Er liegt als Uridintriphosphat in einem Gleichgewicht vor. In der Lösung gibt es nun also neben Uridintriphosphat (UTP) auch dessen Edukte Uridinmonophosphat (UMP) und Pyrophosphat.
In der Zelle aber wird Pyrophosphat zersetzt und damit aus dem Gleichgewicht entfernt. à die Spaltung von UTP in UMP und Pyrophosphat ist irreversibel.
Das Glucose-1-Phosphat reagiert über eine Phosphatsäureanhydridbindung mit UMP zu Uridindiphosphatglucose (UDP-Glucose). Das ist aktivierte Glucose.
GTP (Guanintriphosphat) aktiviert Mannose
CTP (Cytosintriphosphat) wichtig im Peptidstoffwechsel
UTP (Uridintriphosphat) aktiviert den Rest |
