Allgemeines zu den Aminosäuren
Die drei Funktionen der Aminosäuren:
- Bausteine für Proteine
- Energiebereitstellung: AS-Metabolismus
- Vorläufer für Hormone, Neurotransmitter, biologisch aktive Substanzen
Möglichkeiten zur Gewinnung von AS:
- Aufnahme der AS über die Nahrung in Form von Proteinen
- Zerlegung der im Muskel gespeicherten Proteine , ca. 400 g / Tag
- Synthese nicht essentieller AS
Proteine werden in ihre Bestandteile, die AS zerlegt › stetiger Vorrat an AS , ca. 100g /Tag
Aus freien AS werden verschiedene Strukturen synthetisiert:
- Neue Muskelproteine 300 – 400 g / Tag, direkt aus der Nahrung
- Porphyrine, Neurotransmitter, Kreatin, Purine und Pyrimidine(= Bestandteile der Nukleinsäuren), Häm, Nitrogen enthaltende
Stoffe, ca. 30 g / Tag
- Fettsäuren, Ketone, Steroide (› siehe Hormone)
Spaltung vom Proteinen im Organismus mit Hilfe von Enzymen: 
Durch die Dünndarmschleimhaut werden die freien AS resorbiert und gelangen über den Blutstrom via Leber an alle Zellen.
Oligopeptide: max. 20 AS
Polypeptide: mehr als 20 AS
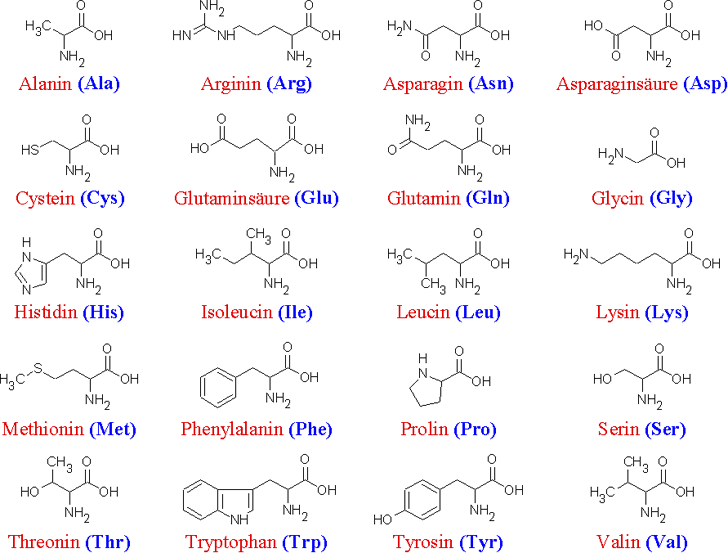
Die 20 wichtigsten Aminosäuren
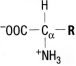
Allgemeine Formel für α-AS:
Unterteilung der L-Aminosäuren in 6 Klassen
Neutrale Aminosäuren:
- Glycin (Gly)
- L-Alanin (Ala)
- L-Serin (Ser)
- L-Threonin (Thr)
- L-Valin (Val)
- L-Leucin (Leu)
- L-Isoleucin (Ile)
Neutrale AS können nicht ionisiert werden, darum heissen sie neutral.
Ser und Thr können an ihrer OH-Gruppe phosphoryliert werden. Viele Enzymaktivitäten werden durch Phosphorylierungen dieser Art reguliert.
Val, Leu und Ile enthalten verzweigte C-Ketten als Reste und sind daher stark hydrophob. Sie kommen häufig in den transmembranären Proteinen vor, und zwar in deren membrandurchspannenden
Domänen. Es sind essentielle AS. Unser Körper kann allgemein keine verzweigte AS synthetisieren.
Essentielle AS : können vom Körper nicht synthetisiert werden und müssen deshalb durch die Nahrung aufgenommen werden.
His, Ile, Leu, Lys, Met, Phe, Thr, Trp, Val
Nichtessentielle AS : werden je nach Bedarf vom Körper synthetisiert.
Ala, Arg, Asp, Asn, Cys, Glu, Gln, Gly, Pro, Ser, Tyr
Saure Aminosäuren und ihre Amide:
- L – Asparartat (Asp)
- L- Asparagin (Asn): Amid
- L- Glutamat (Glu)
- L- Glutamin (Gln): Amid
Bei Asp und Glu wird die OH-Gruppe gegen NH2 ausgetauscht, dadurch entstehen ihre Amide (nicht mehr sauer). Das für den Organismus schädliche NH3 (Ammoniak) kann auf diese Weise neutralisiert
werden.
Asp dient als N-Transporter und ist Vorläufer für GABA und Harnstoff.
Die sauren AS sind ionisierbar und helfen die Proteinstruktur zu stabilisieren. Oft spielen sie beim katalytischen Mechanismus von Enzymen eine wichtige Rolle. Basische Aminosäuren:
- L-Arginin (Arg) : stark basisch wegen des Guanidinrestes
- L-Lysin (Lys) : primäre Amingruppe (-NH).
S-haltige Aminosäuren:
- L-Cystein (Cys)
- L-Methionin (Met)
Durch die Ausbildung von Disulfidbrücken entstehen aus 2 Cys 1 L-Cystin (Cys-Cys).
Durch intramolekulare S-S Brücken werden Proteinstrukturen stabilisiert. Beim Insulin werden z.B die A- und die B-Kette durch zwei solche SS-Brücken zusammengehalten.
Bei Met wird die an das S-Atom gebundene Methylgruppe in Methylierungsprozessen auf andere Moleküle übertragen. Met ist somit ein wichtiger Cofaktor (Helfer der Enzyme).
Aromatische Aminosäuren:
- L-Tyrosin (Tyr)
- L-Phenylalanin (Phe)
Aus Tyr werden Neurotransmitter wie Adrenalin und Dopamin, sowie das Pigment Melanin als auch die Schilddrüsenhormone hergestellt. Phe kann durch Hydroxylierung in Tyr umgewandelt werden (Tyr
= „Hydroxy-Phenylalanin“, vgl. Strukturen !)
Heterozyklische Aminosäuren:
- L-Tryptophan (Trp)
- L-Histidin (His)
- L-Prolin ( Pro)
His bildet das aktive Zentrum vieler Enzyme. Es besitzt als einzige AS einen isoelektrischen Punkt nahe dem physiologischen pH’s.
Beim Prolin (einem Imin) ist das a-C-Atom durch den Heterozyklus blockiert. Als einzige AS besitzt Pro kein primäres Amin (ist Teil des Heterozyklus). In einem Protein führt die Struktur
des Pro zu einem „Knick“ der Aminosäurekette.
Aus Trp wird der Neurotransmitter Serotonin hergestellt.
Da bis auf Glycin (prochiral, da zwei H-Reste !) alle AS ein chirales a-C-Atom besitzen, existieren je eine D- und eine L-Form nach der Fischer’schen Nomenklatur. Im Menschen kommen jedoch
nur L-AS vor, in Bakterien hingegen auch D-AS (z.B. in der Zellwand).
Verhalten der Aminosäuren bei verschiedenen pH-Werten
Am isoelektrischen Punkt heben sich die Ladungen der ionisierbaren Gruppen von Aminosäuren auf (Nettoladung = 0), d.h. die AS liegen in Form eines Zwitter-Ions vor und reagieren somit als Puffer › Aufrechterhaltung
der Homöostase.
|
