Allgemeines
Enzyme sind Proteine, die chemische Reaktionen katalysieren. Sie verfügen über Bindungsstellen, aktive Zentren, die für meistens 2-3 Substrate spezifisch sind. Neben diesen
Substratbindungsstellen sind auch Bindungsstellen für Cofaktoren und Regulatoren vorhanden.
Die katalytischen Aktivitäten eines Enzyms wird durch eine beschränkte Anzahl AS im aktiven Zentrum durchgeführt. Häufig bewirkt die Bindung eines Substrates die Konformationsänderung
des Enzyms, so dass Substrat und die katalytische AS nun in unmittelbarer Nachbarschaft liegen. Dies bewirkt die Auslösung der enzymspezifischen Reaktionen in mehreren Schritten. Beispiele
für enzymspezifische Reaktionen sind: Oxidation, Hydrolyse oder Isomerisierung.
Es gibt mehr oder weniger spezifische Enzyme. Die Hexokinase z.B. reagiert mit allen Hexosen und phosphoryliert sie. Die Glucokinase der Leber hingegen phosphoryliert nur die Glucose und
keine anderen Hexosen wie Galactose oder Mannose.
Verschiedene Typen von Enzymen
Die Enzyme werden nach der von ihnen katalysierten Reaktion benannt. Nach unterteilt sie in obenstehende Klassen, wobei die Oxidoreduktasen und die Hydrolasen mit je 30% aller Enzy-me die
grössten Klassen darstellen.
- Die erste und besonders wichtige Hauptklasse bilden die sog. Oxidoreduktasen. Sie katalysieren Redoxreaktionen, die beim Substratabbau zur Energiegewinnung eine ausserordentlich grosse
Rolle spielen. 30% der Enzyme
- Zur zweiten Gruppe der Enzyme, den Transferasen, gehören diejenigen Enzyme, die den Transfer einer Gruppe X zwischen zwei Substraten S und S‘ katalysieren. Beispiele für
diese wichtige Gruppe von Enzymen sind die Kinasen, die den Phosphattransfer von ATP auf entsprechende Substrate vermitteln. 10% der Enzyme. Sie übertragen z.B. Methy-, Amino- oder Phosphatgruppen
auf andere Moleküle.
- Eine für den Abbau verschiedener Makromoleküle besonders wichtige Gruppe von Enzymen sind die Hydrolasen. Sie katalysieren ganz allgemein die hydrolytische Spaltung von Estern,
Ethern, Peptiden, Glykosiden, Säureanhydriden oder C-C-Bindungen, d.h. sie helfen Makromoleküle zu zerlegen. Hauptvertreter dieser dritten Hauptklasse sind die vielen Hydrolasen
des Verdauungstraktes. 30% aller Enzyme sind Hydrolasen.
- Lyasen katalysieren im Gegensatz zu den Hydrolasen die nichthydrolytische Abspaltung von verschiedenen Gruppen. Gespalten werden
C-C, C-O, C-N und C-S Bindungen
- Isomerasen sind Enzyme, die die Umwandlung der verschiedenen in der Natur vorkommenden Isomere ineinander ermöglichen. Zu ihnen gehören die Aldose-Ketose-Isomerasen
der Glykolyse, die verschiedenen Epimerasen sowie die Cis-Trans Isome-rasen.
- Die letzte Hauptgruppe von Enzymen stellen schliesslich die Ligasen dar. Sie werden im wesentlichen für biosynthetische Prozesse benutzt und katalysieren die energieabhängige
Knüpfung von Bindungen.
Isoenzyme
Häufig kommen Proteine in sog. Isoformen vor, im Fall von Enzymen spricht man dann von Isoenzymen. Diese katalysieren zwar dieselbe Reaktion, unterscheiden sich jedoch in ihrer AS-Sequenz.
Ihre nahe Verwandtschaft, jedoch nicht Identität, befähigt sie zum Umsatz der gleichen Substrate, aber mit (gering) unterschiedlicher Aktivität.
Isoenzyme sind in tierischen und pflanzlichen Zellen weit verbreitet und häufig organ- oder zellspezifisch verteilt. Bisher kennt man Isoenzyme bei Dehydrogenasen, Oxidasen, Trans-aminasen,
Phosphatasen, Transphosphrylasen und Proteasen.
Von medizinischem Interesse sind die im Serum des Menschen vorkommenden 5 verschiedenen Isoenzyme der Lactatdehydrogenase (LDH). Sie bestehen aus jeweils 4 Unter-einheiten, die in 2 unterschiedlichen
Typen vorkommt, dem Typ H und dem Typ M. Diese Untereinheiten, die enzymatisch inaktiv sind, können unter geeigneten Bedingungen zu einem Tetramer assoziieren und erlangen dabei wieder
enzymatische Aktivität:
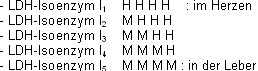
Das Verhältnis der Isoenzyme zueinander ändert sich bei bestimmten Erkrankungen. So ist nach einem Herzinfarkt der LDH I1 Spiegel stark erhöht, da viele Herzzellen zerstört
wurden.
Weitere Isoenzyme sind die Keratinkinase und die Aspartattransferase, die ebenfalls nach einem Herzinfarkt in erhöhter Konzentration vorkommen, allerdings mit einem anderen zeitlichen
Spitzenwert.
Cofaktoren und Vitamine
Als Cofaktoren kommen anorganische Spurenelemente wie die Ionen der Metalle Mg, Fe, Cu, Zn, Mo und Co in Frage oder organischeVitaminderivate. Die Vitamine werden dabei aktiviert.
Vitamin (Vorläufer für organische Cofaktoren) › intestinale Resorption › Transport im Blut › Aufnahme in Zellen › Umwandlung zum Coenzym › Assoziation
mit Apoenzym ( En-zym ohne Cofaktor, inaktiv) › Holoenzym ( Enzym mit Cofaktor, aktiv)
Die Vitamine werden in verschiedene Klassen eingeteilt:
- Fett lösliche: A, D, E, K
- Wasser lösliche
- nicht B-Komplex › Vitamin C
- B-Komplexe
Die B-Komplexe werden noch weiter aufgeteilt:
- energieverbrauchende: Thiamine ( Vit.B1), Riboflavin ( Vit. B2), Niacin ( Vit. B3), Biotin, Pantothensäure
- Hematopoetische: Folsäure, Vit. B12
- Andere: Pyridoxin ( Vit. B5), Pyridoxal, Pyridoxamin
Die B-Komplex Vitamine dienen hauptsächlich als Vorläufer der Coenzyme.
Enzymkinetik
Temperaturabhängigkeit: Steigt die Temperatur an, so steigt auch die Reaktionsgeschwindigkeit (RG) katalysierter Reaktionen in einem bestimmten Bereich
an. Man verwendet für die Temperaturerhöhung einen Beschleunigungsfaktor Q. Erhöht man die Temperatur um 10° C so lautet der Be-schleunigungsfaktor Q10. Oft liegt Q10 im
Bereich von 2, d.h. eine Temperaturerhöhung um 10° C verdoppelt die RG.
Übersteigt die Temperatur das Temperaturoptimum, nimmt die RG schnell ab, da die Enzyme durch die Hitze denaturiert werden. Die meisten Enzyme haben ihr Optimum bei 37°C.
Ist das Substrat im Überfluss vorhanden, ist die Reaktionsgeschwindigkeit (RG) proportional zur Enzymkonzentration.
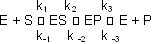
Wichtig ist, dass die Anfangsgeschwindigkeit der Reaktion gemessen wird, bei der erst wenig Substrat umgesetzt ist.
Im Fliessgleichgewicht ist die Bildungs- und die Zerfallgeschwindigkeit des ES Komplexes gleich gross: [Et] = Enzymkonzentration
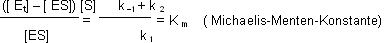
Km beschreibt, nach welcher Zeit t eine vom Substrat abhängige Reaktion die Hälfte ihrer maximalen RG erreicht. Auf die Enzyme bezogen: Die Gleichung beschreibt das Verhalten vieler
Enzyme in Abhängigkeit von der Substratkonzentration. 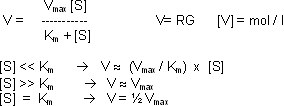
Übliche V für Enzyme: 10 – 5 bis 10 – 3 mol /l
Häufig wird die RG eines Enzym in einer linearen Grafik aufgetragen
Inhibition der Enzyme
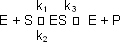
Die Inhibitoren I können an verschiedenen Stellen angreifen:
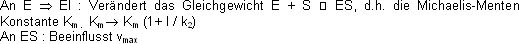
Aufgrund dieser Indizien lässt sich bestimmen, wo der Inhibitor angreift!
Kompetitive Inhibitoren:
Der Inhibitor konkurriert mit dem Substrat und geht eine Bindung mit dem Enzym ein:

Der Inhibitor bindet spezifisch an das aktive Zentrum des Enzyms. Da die Konzentration des ES Komplexes unverändert bleibt, bleibt vmax gleich. Allerdings ändert sich das Gleichgewicht
und Km steigt ( das Enzym hat weniger Affinität für das Substrat).
Nicht kompetitive Inhibitoren:
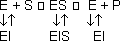
Der Inhibitor bindet nicht an das aktive Zentrum und kann somit auch binden, wenn das Substrat schon gebunden ist. Da der Inhibitor überall mit gleicher Wahrscheinlichkeit bindet, ändert
sich das Gleichgewicht nicht. Da jedoch die Konzentration von ES verändert wird, sinkt vmax.
Unkompetitive Inhibitoren:
Der Inhibitor greift nur den ES Komplex an:

Da dieser Inhibitor die ES Konzentration ändert, sinken die Km und vmax.
Regulation von Enzymen
- Allosterische Regulation: Die Enzymaktivität wird durch die Konzentration des Substrates, eines Zwischenproduktes oder des Produktes reguliert. Die Schlüsselenzyme einer
Reaktionsabfolge werden häufig allosterische kontrolliert wie z.B. die Phosphofructokinase der Glykolyse.
- Posttranslatorische Modifikationen: Enzyme können nach der Translation
aktiviert oder inaktiviert werden
- Gen-Repression: Durch Repressoren kann die Enzymsynthese auf der Stufe der DNA kontrolliert werden.
- Phosphorylierung: Enzyme können durch anhängen eines Phosphatrestes an gewisse AS aktiviert oder inaktiviert werden je nach Enzym. Die Pyruvatdehydrogenase z.B. wird durch
Phosphorylierung inaktiviert. Die Phosphorylierung ist eine besonders häufige Form der posttranslationellen Modifikaiton.
Allosterisch regulierte Enzyme bestehen aus mehreren Untereinheiten, die in verschiedenen Konformationen vorkommen. Ein gutes Beispiel ist das Hämoglobin, welches aus vier Unter-einheiten
aufgebaut ist, die zwei verschiedene Zustände kennen: tended und relaxed. Die Un-tereinheiten verfügen jeweils über zwei Bindungsstellen: eine für das Substrat, eine für
den Regulator. Ist das Substrat zugleich Regulator spricht man von einem homotropen Effektor. Effektoren:
Ändern Effektoren die RG eines Enzymes spricht man vom V-System.
Ändern Effektoren die Affinität eines Enzymes handelt es sich um ein K-System.
K-System:
Ein positiver Effektor begünstigt die Substratbindung, d.h. er erhöht die Affinität des Enzy-mes für das Substrat und senkt die Zeit, bis die Hälfte der vmax erreicht
ist (k1/2).
Ein negativer Effektor hindert die Bindung des Substrat und senkt die Affinität des Enzymes. Dadurch steigt k1/2 , es dauert als länger bis die Hälfte der maximalen RG erreicht
ist. V-System:
Ein Effektor nach dem V-System ändert die Affinität des Enzymes für sein Substrat nicht, somit bleibt auch k1/2 gleich.
Ein positiver Effektor erhöht vmax. Je mehr positiven Effektor man zugibt, umso schneller läuft die Reaktion ab. |
