Kohlenhydrate (Cn(H2O)n › Polyhydroxycarbonylverbindungen
Einfachster Vertreter dieser Gruppe: Formaldehyd › CH2-O
Zucker ist die Trivialbezeichnung für Saccharide und umfasst eine sehr unfangreiche Klasse von Verbindungen, welche in Mono- und Polysaccharide eingeteilt wird.
Monosaccharide
Die einfachsten Monosaccharide enthalten nur 3 C-Atome (Tetrosen), es sind Glycerinaldehyd und 1,3-Dihydroxyaceton.
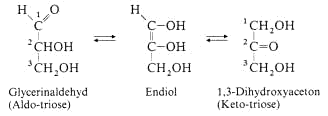
Mit längerer C-Atomkette kommt man über die Triosen und Pentosen zu den Hexosen. Die Kette wird ausgehend von der Aldehydgruppe (C1) nummeriert. Bei Ketosen erhält das C-Atom der CO-Gruppe
die Ziffer 2.

Aldosen und Ketosen enthalten, mit Ausnahme des Dihydroacetons, mindestens ein Chiralitätszentrum.
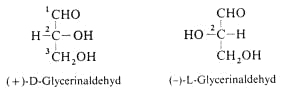
Aldo-Tetrosen wie die Threose und Erythrose besitzen zwei Chiralitätszentren. Es gibt 22 = 4 Stereoisomere.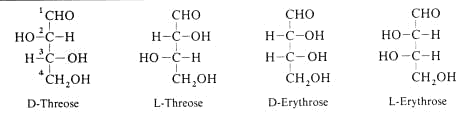
Die Begriffe “threo“ und “erythro“ kennzeichnen die Stereochemie zweier benachbarter C-Atome und leiten sich von den Tetrosen ab.
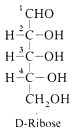
Von den Aldo-Pentosen existieren schon 23 = 8 Stereoisomere. Die D-Ribose, ein Baustein der RNA, ist ein wichtiges Beispiel.
Die wichtigsten Monosaccharide, die Hexosen, haben die Summenformel C6h22O6. Von den Aldo-Hexosen gibt es 24 = 16 Stereoisomere, eines von diesen ist die weitverbreitete D-Glucose. Die Konfiguration
am C5 bestimmt ihre Zugehörigkeit zur D-Reihe. Der Stamm “Gluco“ im Namen Glucose legt die Konfiguration der anderen Chiralitätszentren fest. Um die Anordnung der OH-Gruppen vom
C1 kommend (rechts, links, rechts, rechts) zu merken, kann evtl. die Feuerwehr mit “ta, tü, ta, ta“ helfen.
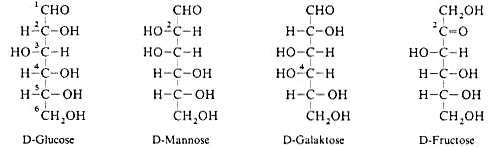
Zwei andere Aldo-Hexosen, die D-Mannose und D-Galaktose, haben ausserdem im Stoffwechsel eine Bedeutung. Sie unterscheiden sich von der D-Glucose jeweils nur in der Konfiguration an einem C-Atom, Mannose
an C2, Galaktose an C4. Alle drei Verbindungen sind diastereomer zueinander.
Monosaccharide sind durch die vielen Hydroxygruppen im Molekül gut Wasserlöslich und in lipiphilen organischen
Solventien unlöslich. Die offenkettige Schreibweise entspricht nicht der Realität. Die Glucose liegt in Lösung nur zu 0,02% in der linearen Form mit einer freien Formylgruppe vor. Die Hydroxylgruppe an C5 kann
mit der Formylgruppe ein sechsgliedriges Hemiacetal bilden, welches von allen möglichen Hemiacetalen das Produkt mit dem niedrigsten Energiegehalt ist. In dieser Form der D-Glucose stehen alle
Rungsubstituenten (Hydroxylgruppen und die CH2OH-Gruppe) äquatorial
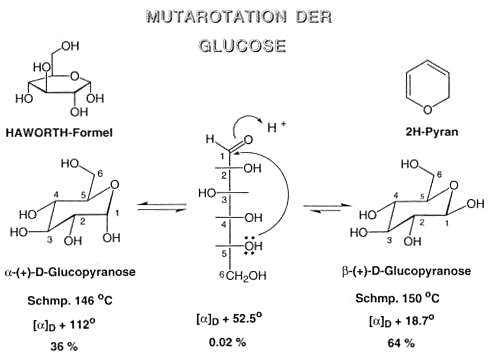
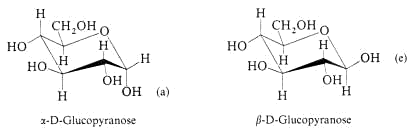
a- und b- Glucose sind Diastereomere.
Diastereomere mit mehreren Chiralitäszentren, die sich aber nur an einem Chiralitätszentrum unterscheiden, nennt man Epimere.
Epimere, welche miteinander im thermodynamischen Gleichgewicht stehen, nennt man Anomere.
Stereoisomere Kohlenhydrate, die sich in der Konfiguration am ehemaligen Carbonyl-C-Atom unterscheiden, heissen Anomere.
Obwohl nur die vorherige Darstellungswiese der Glucose und anderer Hexosen die richtige Gestallt der Moleküle wiedergibt, wird heute noch in manchen Lehrbüchern die nicht mehr zeitgemässe
Darstellung nach Harworth verwendet, bei der der Pyranose-Ring planar und die Liganden axial gezeichnet werden.
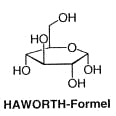
Die Glucose ist die einzige Struktur, wo alle Liganden äquatorial angeordnet sind, bis auf die OH-Gruppe an C1 › wird oft mit einer Wellenlinie gekennzeichnet.
Es stellt sich nun die Frage, warum b-Glucose bevorzugt wird.
Zwischen der OH-Gruppe von C1 und C2 bei der a-Glucose gibt es eine Wechselwirkung. Bei der b-Glucose kommt diese Wechselwirkung nicht vor.
Drehwerte
[a]D = +112° › α-Glucose
[a]D = +19° › β-Glucose
Der Drehwert der Mischung beträgt [a]D = +54° (Gleichgewicht).
Dieses Phänomen nennt man Mutarotation.
α ist stärker rotatorisch › kommt weniger vor
β ist schwächer rotatorisch › kommt mehr vor
Vorsicht: Der Drehwert hat nichts mit der Stabilität zu tum!
Pentosen
ur Nomenklatur: D - (+) - β - Gluco pyran ose
D › rechts, gibt die absolute Konfiguration am letzten Chiralitätszenturm an
(+) › Vorzeichen des optischen Drehwerts
β› relative Konfiguration des anomeren C-Atoms
Gluco › relative Konfiguration aller sekundären Alkoholgruppen
pyran › 6-gliedrig
ose › Saccharid
Sesselform-Schreibweise der Pyranosen
Haworth-Formeln beschreiben Pyranosen nicht vollständig. Konstitution und Konfiguration lassen sich erkennen, nicht jedoch die Konformation des Sechsringes. Es fehlt somit die Information über
die räumliche Anordnung der Substituenten. Diese wird zugänglich, wenn man die Pyranosen in der Sesselform aufschreibt.
Aus der Röntgenstruktur geht hervor, dass sich der Sechsring mit dem Sauerstoffatom wie ein Cyclohexanring verhält und in der Regel die energetisch günstigere Sesselform einnimmt
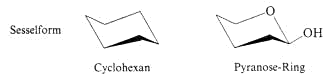
Der Sessel ist so geklappt, dass möglichst viele Substituenten äquatorial (e) stehen, insbesondere die sperrige CH2OH-Gruppe an C5. b-D-Glucopyranose weist nur äquatoriale Substituenten
auf. Im a-Anomer steht die anomere OH-Gruppe an C1 axial (a).
In der Sesselform-Schreibweise der b-D-Glucopyranose erkennt man, dass die benachbarten Substituenten am Ring jeweils “trans“ zueinander stehen (e, e-Anordnung = trans). Die Glucose ist
damit das energieärmste Molekül aus der Reihe der Aldohexosen, was sicher der Grund für ihre bedeutende Rolle in der Natur ist. Für das anomere C-Atom beobachtet man häufig,
dass ein axiales OH (a-Form) die Konformation besser stabilisiert als ein äquatoriales (b-Form).
Fischersche Konvention
1. Das (chirale) Molekül wird so dargestellt, dass die länste Kohlenstoffkette senkrecht steht:
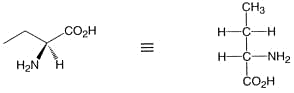
2. Das Kohlenstoffatom der höchsten Oxidationszahl nimmt die obere Stellung (den “Kopf der Formel) ein:
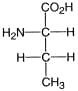
3. Die Konfiguration (D oder L) wird zugeordnet, je nachdem sich das Heteroatom an der linken oder rechten Seite steht:
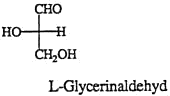
Glykoside
Wie die Halbacetale (Halbketale) von Aldehyden und Ketonen können auch die cyclischen Halbacetale (Halbketale) der Monosaccharide mit Alkoholen zu den Acetalen (Ketalen) weiterreagieren. Mann
nennt die Acetale und Ketale der Monosaccharide Glykoside. Bei der Bildung der Glykoside wird Wasser frei, man arbeitet daher bei ihrer Darstellung unter wasserfreien Bedinungen und benötigt eine
starke Säure als Katalysator. Mit Methaol und einer Spur konzentrierter Schwefelsäure erhält man Methylglykoside. Diese Reaktion ist reversibel, d.h. Glykoside lassen sich mit wässriger
Säure zum freien Monosaccharid und zur Alkoholkomponente hydrolisieren.
Die Bindung vom Sauerstoffatom des Alkohols zum anomeren C-Atom eines Monosaccharids heisst glykosidische Bindung.
Disaccharide
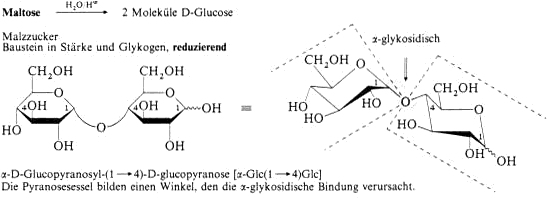
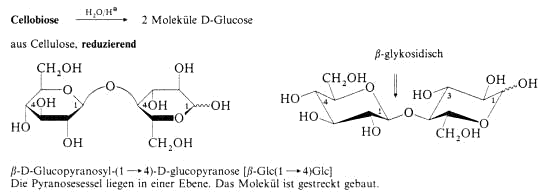
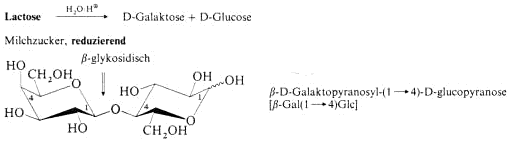
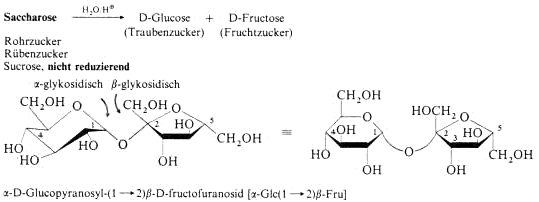
Polysaccharide
Die Monosaccharide sind Bausteine, die durch die glykosidische Bindung auch über die Disaccharide hinaus miteinander verknüpft werden können. Die Polysaccharide gehören wie die
Polypeptide und die Nukleinsäuren zu den Biopolymeren, die durch Polykondensation (Polymerisation unter Wasserabspaltung) entstehen. Die wichtigsten Polysaccharide sind Cellulose, Stärke und
Glykogen.
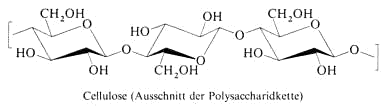
Cellulose ist das Strukturmaterial der Pflanzen.
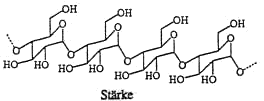
Stärke kommt in allen Pflanzen als Sauerstoffspeicher vor. Stärke ist kein einheitlicher Stoff. Mit heissem Wasser lösst sich ein Teil (ca. 25%) heraus und wird als Amylose bezeichnet.
Der unlösliche Rückstand ist das Amylopektin.
|
