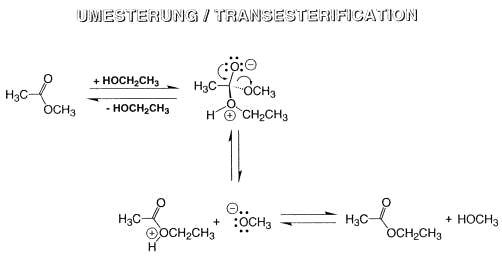
Claisenkondensation
Der Mechanismus der Claisen-Kondenstion ist ganz analog demjenigen der Aldol-Kondensation. Die Claisen-Kondensation spielt in der Biosynthese mehrerer wichtiger Matabolite eine zentrale Rolle.
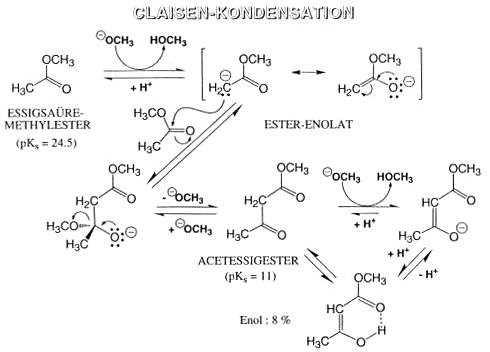
Die biologischen Äquivalente des Acetessigesters (Acetoacetyl-CoenzymA und Acetoacatyl ACP) sind die Biosynthese-Vorläufer der Terpenoide, der Polyketide und der Fettsäuren.
Die freie
Acetessigsäure ist im Gegensatz zu ihren Ester nicht stabil
Thioester
Thioalkohole (= Mercaptane) können wie Alkohole mit Carbonsäuren Ester bilden, die Thioester heissen. Bei der chemischen Synthese muss man vom reaktiven Säurechlorid ausgehen.
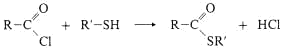
Thioester sind dem nucleophilen Angriff des Wassers (Hydrolyse) oder anderer Nucleophile am Carbonyl-C-Atom leichter zugänglich als normale Ester, sie sind “energiereicher“. In der
Natur wird dies ausgenutzt, um Acylgruppen aus einem Thioester auf Hydroxy- oder Amino-gruppen zu übertragen, was vom normalen Ester ausgehend energetisch ungünstig ist. Trägersubstanz
für Acylgruppen ist das Coenzym A, das an seiner endständigen Thiolgruppe unter Energiezufuhr (ATP-Hydrolyse) acyliert wird.
Acetyl-Coenzym A ist eine Schlüsselsubstanz im Stoffwechsel und kann Alkohole enzymatisch acetylieren, ähnlich, wie es der Chemiker mit Acetanhydrid im Reagensglas macht
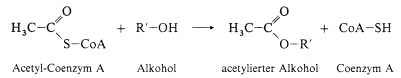
Ausserdem ist Acetyl-Co A Vorstufe bei der Biosynthese der Fettsäuren und Sterodie und im Stoffwechsel der Mikroorganismen für eine Reihe von Antibiotika (Acetogenine).
Acetogenine
- Chinonoide Farbstoffe (z.B. Emodin, Carmisäure, Kermessäure)
- Flavonoide (z.B. Luteolin, Quercetin)
- Aflatoxine (Carcinogene Toxine aus Schimmelpilzen)
- Tetracycline (Antibiotika aus Streptomyces-Schimmelpilzen)
Ammonolyse › Amid-Bildung
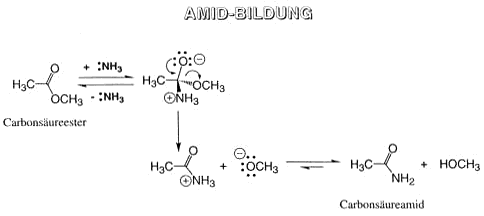
Carbonsäure-Amide
Versetzt man Carbonsäuren mit Ammoniak oder Aminen, dann bildet sich das Ammoniumsalz
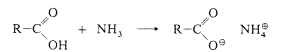
Cyclische Amide heissen Lactame, je nach Ringgrösse b-Lactam, g-Lactam oder d-Lactam. Ist eine NH-Gruppe von zwei CO-Gruppen flankiert, spricht man von Imiden. Lactame und Imide spielen bei vielen
heterocyclischen Naturstoffen eine Rolle.
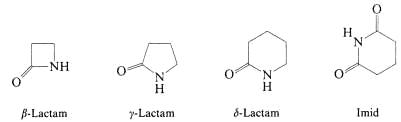
Klassifizierung der Proteine
Proteine
- Globuläre Proteine: Albunine, Globuline, Histone,...
- Fibriläre Proteine ® Strukturproteine (zB. Kollagen)
- Peptidhormone: Angiotensin, Renin, ACTH
Proteide
- Transportproteine (Hämoglobin)
- Enzyme (Biokatalysatoren)
- operationelle Proteine: Myosin, Actin, Ribosomen
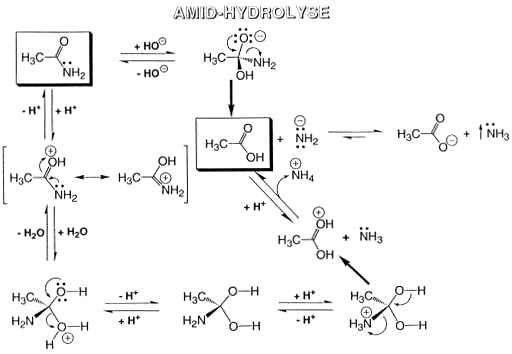
Amid-Hydrolys
Heterocyclen
Heterocyclen entsprechen in ihrem ringförmigen Bau den Cycloalkanen oder den aromatischen Kohlenwasserstoffen. Merkmal für einen Heterocyclus ist, dass sich neben Kohlenwasserstoffatomen
noch andere Atome, wie N-, O- oder S-Atome, am Aufbau der Ringe beteiligen. Man unterscheidet zwischen aliphatischen und aromatischen Heterocyclen. Die aliphatischen entsprechen in ihren Eigenschaften
in etwa den offenkettigen Verbindungen mit Heteroaromaten, also den Aminen, Ethern und Thioethern. Hingegen sind die aromatsichen Heterocyclen vielfältige und interessante Bausteine organischer
Verbindungen und spielen auch in der Natur eine wichtige Rolle.
p-Überschuss-Heteroaromaten (Enamin-Reaktivität)
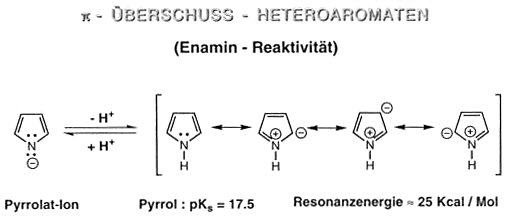
Pyrrol, Furan und Thiophen sind die drei kleinsten aromatischen Heterocyclen mit einem Heteroatom im Ring.
Hier ist jeweils ein freies Elektronenpaar am Heteroatom mit zwei Doppelbindungen konjugiert.
Da ein 6p-Eletronensystem entsteht, sind die Verbindungen aromatisch. Die p-Elektronen sind wie im Benzol über
alle Ringatome delokalisiert. Pyrrol
Gegenüber den Resonanzstrukturen beim Benzol treten beim Pyrrol dipolare Formen auf (siehe Mesomerie des Pyrrols).
Das freie Elektronenpaar des N-Atoms gehört zum p-System, das die Aromatizität ausmacht, und lagert nur schwer ein Proton an. Pyrrol ist deshalb eine sehr schwache Base. Eher gibt es das
Proton vom N-Atom ab und wird zum Anion.
Die C-Atome des Fünfrings sind, verglichen mit dem Benzol, elektronenreicher und reagieren leichter mit Elektrophilen
Pyrrolidin
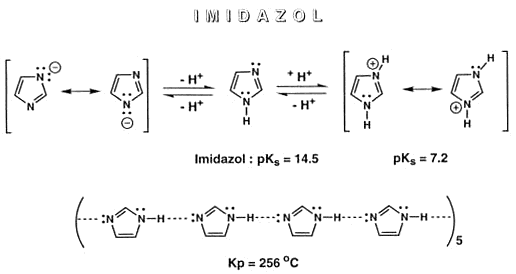
Imidazol
Ein Fünfring kann auch mehrere Heteroatome enthalten, ein Beispiel ist das Imidazol mit zwei N-Atomen im Ring. Imidazol ist eine mittelstarke Base, da sich das freie Elektronenpaar des einen
Stickstoffatoms nicht am 6p-Elektronensystem (Aromat) beteiligt. Imidazol ist Baustein der Aminosäure Histidin.
p-Mangel-Heteroaromaten (Imin-Reaktivität) 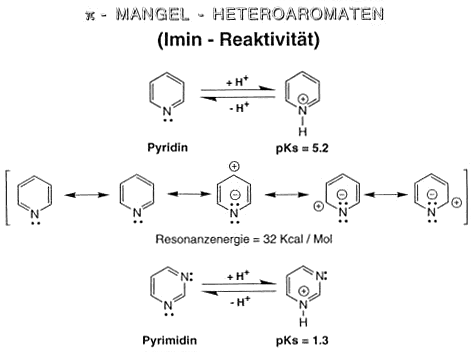
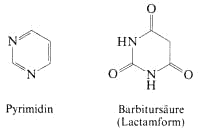
Pyrimidin
Das basische Pyrimidin enthält zwei Stickstoffatome im aromatischen Sechsring. Vom Pyrimidin leitet sich eine Gruppe wirksamer Schlafmittel ab, die Barbiturate.
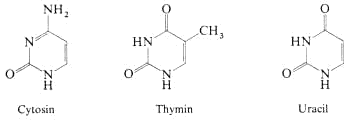
Die wichtigsten Pyrimidinbasen sind Cytosin, Thymin und Uracil, die in den Nukleinsäuren vorkommen.
Methylpyrimidine
Methylgruppe stabilisert das Molekül, das N-Atom kann weniger Elektronen von C an sich ziehen Þ N nimmt leichter Elektronen auf Þ wird eine starke Base
Mehrkernige Heterocyclen
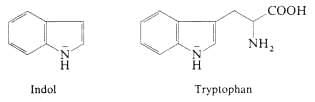
Indol
Viele Heterocyclen enthalten mehrere Ringe, die z.T. auch rein carbocyclisch sein können. Man spricht von mehrkernigen Heterocyclen.
Indolderivate sind als basische Pflanzeninhaltsstoffe - Alkaloide
- weit verbreitet.
Auch die Aminosäure Tryptophan ist ein Indolderivat. Der Indol-Stickstoff ist im übrigen aus den gleichen Gründen wie der Pyrrol-Stickstoff nicht basisch.
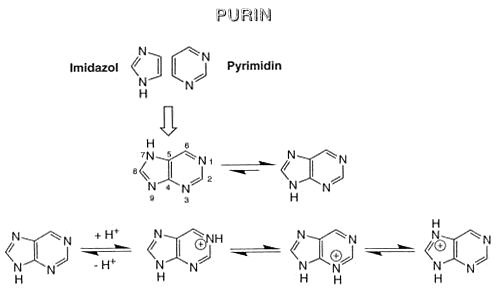
Nucleinsäuren
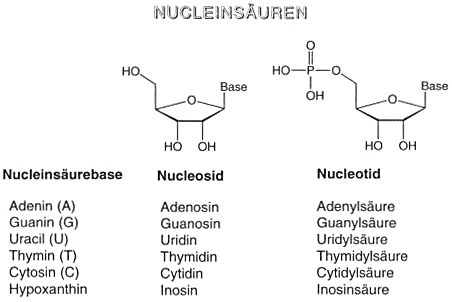
Wir haben inzwischen alle Bausteine kennengelernt, die in den Nukleinsäuren vorkommen: Phosphorsäure, Zucker, Purin- und Pyrimidinbasen.
Man unterscheidet zwei Typen von Nukleinsäuren: Ribonukleinsäure (RNA) mit D-Ribose und Desoxyribonukleinsäure (DNA) mit 2-Desoxy-D-Ribose als Zuckeranteil
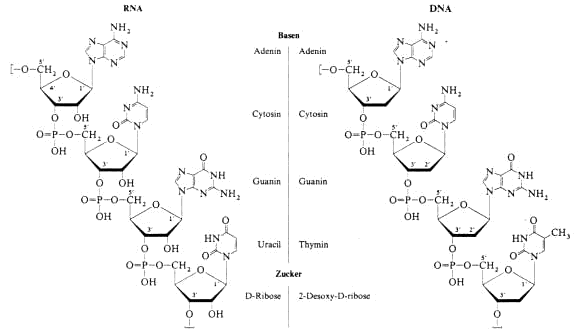
In der RNA sind Ribose-Moleküle als Furanoside im 3’- und 5’- Stellung über Phosphorsäure-diester-Gruppen zu langen Ketten verknüpft. Am anomeren C-1’ der Zucker
sind die Nukleinbasen b-N-glykosidisch gebunden. Adenin, Cytosin, Guanin und Uracil stellen “Sonden“ dar, die in die Umgebung wirken und der Zuckerphosphat-Kette durch ihre Aufeinanderfolge
ein individuelles Gesicht geben. Die DNA ist analog gebaut, es fehlt jedoch den Zuckern die 2’-OH-Gruppe und bei den Basen ist Uracil durch Thymin ersetzt.
Die Basen der DNA-Ketten bilden untereinander Wasserstoffbrückenbindungen aus und zwar treten Adenin mit Thymin und Guanin mit Cytosin in Wechselwirkung. Die Basen erkennen sich gegenseitig.
Eine optimale Zahl von H-Brücken gibt es, wenn die zweite Kette zur ersten komplementär ist, dass also jeder Base in Kette 1 der passende Partner in Kette 2 gegenübersteht.
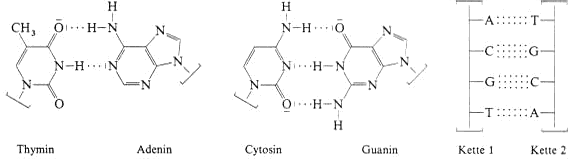
Solchermassen “gepaarte“ DNA-Ketten sind ineinander verdreht und bilden die sogenannte Doppelhelix, in deren Innern die Basen stehen und die durch die hydrophilen Phosphorsäure-diester-Gruppen
gegen das Lösungsmittel Wasser abgeschirmt werden.
Jeweils drei aufeinanderfolgende Basen (Triplett) stehen für eine bestimmte Aminosäure (z.B. GCA = Alanin) oder bedeuten einen Ablesestop
|
