Alkane (Parafine) bilden die einfachste Verbindungsklasse der Kohlenwasserstoffe und weisen Summenformelen der Form CnH2n auf.
Cycloalkane
Cycloalkane leiten sich formal von den n-Alkanen ab, indem jeweils am Kettenende ein H-Atom entfernt wird und die Enden über eine neue C-C-Bindung einen Ring schliessen. Man benennt cyclische
Kohlenwasserstoffe nach der Zahl der C-Atome im Ring wie die n-Alkane und ergänzt mit der Vorsilbe “cyclo-“.
Cycloalkane bilden eine homologe Reihe, deren allgemeine Summenformel CnH2n ist.
Im Cyclopropan weichen die Bindungswinkel der s-Bindungen stark vom Tetraederwinkel ab. Der Ring ist gespannt. Die normale sp3-Hybridisierung der C-Atome ist gestört. Mit zunehmender Ringgrösse
nähern sich die Bindungswinkel dem normalen Tetraederwinkel von 109,5°. Beim Cyclohexan, dem wichtigsten Cycloalkan, ist dies voll verwirklicht. Der Sechsring ist spannungsfrei. Allerdings
ist das Molekül nicht mehr eben gebaut.
Konformation des Cyclohexans.
Cyclohexan kann verschiedene Konformationen einnehmen, ohne dass sich die Grösse der Bindungswinkel ändert. Die energieärmste Konformation ist die Sesselform, eine energiereichere
die Wannenform. Dazwischen gibt es zahlreiche Übergänge.
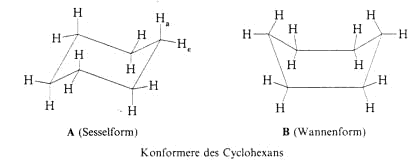
In der Sesselform trägt jedes C-Atom ein senkrecht nach oben bzw. unten zeigendes H-Atom. Man bezeichnet dieses H-Atom als axial (a) und das an jedem C-Atom seitlich am Ring stehende als äquatorial
(e). Am Molekülmodell oder in der Newmann–Projektion wird deutlich, warum die Sesselform energetisch günstiger ist als die Wannenform. In der Sesselform liegen alle benachbarten C mit
ihren H–Atomen in der gestaffelten Konformation vor, während in der Wannenform die weniger begünstigte ekliptische Konformation vorkommt. Der Unterschied beträgt etwa 25 kJ/mol.
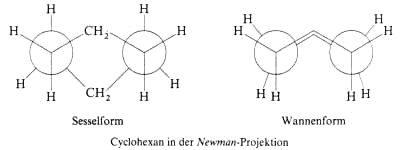
Nach dem Umklappen von einer Sesselform in die andere sind aus allen axialen H-Atome äquatoriale und umgekehrt aus allen äquatorialen H-Atomen axiale geworden. Cyclohexanderivate
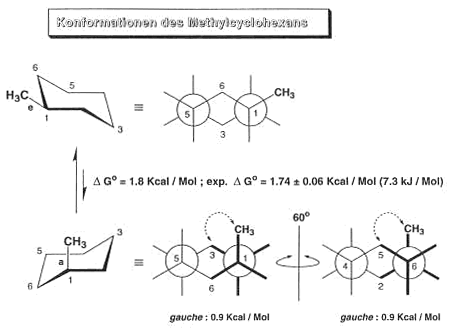
Trägt ein C-Atom des Cyclohexans einen Substituenten, z.B. Methyl, so überwiegt im Gleichgewicht das Konformere mit äquatorialem Methyl. Hier lassen sich zwischen den axialen H-Atomen
und dem axialen Methyl abstossene Wechselwirkungen vermeiden.
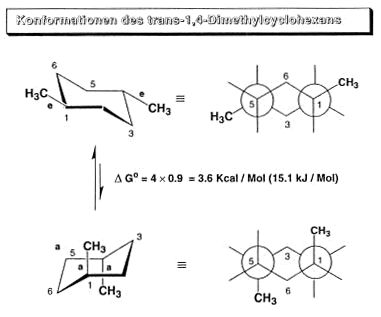
Vom 1,2,-Dimethyl–cyclojexan existieren zwei Isomere. Es begegnet uns eine neue Art der Isomerie die cis-trans-Isomerie der Cyclohexanderivate.
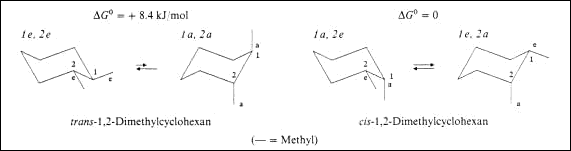
Von den Isomeren existieren wiederum zahlreiche Konformere . Normalerweise überwiegt die Sesselform, und es ist das Konformere am energieärmsten, das die maximale Anzahl äquatorialer
Substituenten bzw. die grössten Substituenten in äquatorialer Stellung aufweist. Vorsicht: äquatoriale Stellung nur bei trans bevorzugt, bei cis ist DG0 = 0
Reaktionen der Alkane
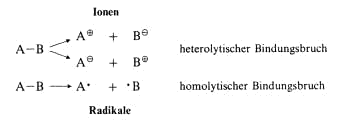
Homolytischer/ heterolytischer Bindungsbruch
Alkane verhalten sich gegenüber den meisten chem. Reagentien sehr reaktionsträge. Die wichtigsten Reaktionen der Alkane werden leichter verständlich, wenn man sich klar macht, dass die
unpolaren C–C bzw. C–H-Bindungen vorwiegend homolytisch brechen. Dies bedeutet, dass bei jedem Partner ein Elektron aus dem ehemals bindenden Elektronenpaar verbleibt. Die Teilchen, die
dabei auftreten, haben ein ungepaartes Valenzelektron, das man durch einen Punkt am zugehörigen Atom markiert. Solche Teilchen bezeichnet man als Radikale , sie sind sehr reaktiv. In diesem Sinn
sind auch das H-Atom, das Cl-Atom und auch das Sauerstoffmolekül Radikale:
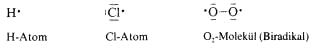
Im Gegensatz zum homolytischen steht der Heterolytische Bindungsbruch. Hier verbleibt das bindende Elektronenpaar bei dem Bindungspartner, als Folge treten Ionen auf.
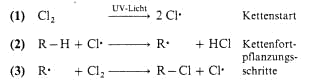
Radikalische Halogenierung
Allgemein ausgedrückt wird ein H-Atom im Kohlenwasserstoff durch ein Chloratom ersetzt, es entsteht ein Alkylchlorid. Die Reaktion ist vom Typ eine Substitution, deren Ablauf wir genauer ansehen
wollen:
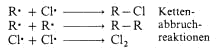
Eine Radikalbildung durch ein Iodatom ist energetisch so ungünstig, dass es eine radikalische Iodierung praktisch nicht gibt. Iod kann deshalb als Radikalfänger auftreten, was zum Kettenabbruch
führt. Iod-Atome können nur noch rekombinieren.
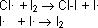
Unter physiologischen Bedingungen wirken Vitamin K-Hydrochinon oder Thioalkohole als Radikalfänger
|
