Im gewinkelt gebauten Ammoniak bilden die H-Atome die Basis einer Pyramide, in deren Spitze das N-Atom mit seinem freien Elektronenpaar steht.
Ersetzt man die H-Atome nacheinander durch organische Reste, kommt man über die primären zu den sekundären und tertiären Amine
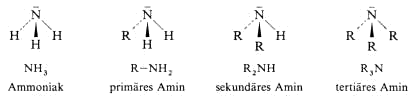
Amine sind basischer als Ammoniak, weil die Alkylsubstituenten die Elektronendichte am Stickstoffatom erhöhen. Diese Tendenz wird bei tertiären
Aminen durch einen sterischen Effekt teilweise wieder aufgehoben.
Basizität
Amine sind wie Ammoniak Basen und lagern ein Proton an das freie Elektronenpaar an.
Je kleiner der pKb-Wert, desto grösser ist die Basizität des Amins.
Als Nukleophilie wird die Affinität eines Teilchens (Ion oder Molekül) für einen elektrisch positiv geladenen Reaktionspartner bezeichnet.
Basizität ist die Nukleophilie für
das Proton.
Pearson
Pearson hat in den 60er Jahren die Begriffe der harten und weichen Säuren und Basen geprägt. Harte Basen bzw. harte Nukleophile sind dadurch charakterisiert, dass sie einen kleinen Ionenradius,
eine hohe effektive Kernladung (Ladung des Kerns unter Abzug der nicht bindenendn Elektronen der inneren Schalen), eine hohe EN und eine kleine Polarisierbarkeit aufweisen.
Es fällt nicht leicht, eine quantitative Skala aufzustellen, da der Begriff nicht auf einer messbaren Gleichgewichtskonstante beruht, sondern eher qualitativ aus gemessenen Geschwindigkeitskonstanten
vergleichbarer Reaktionen abgeleitet wird.
Die folgende Rheienfolge von nach abnehmender Härte geordneten Teilchen hat daher nur illustrativen Charakter:
F- › OR- › NR3- › Cl- › Br- › SR-
Also: Hartes Nukleophil:
- kleiner Ionenradius
- hohe effektive Ladung auf kleiner Oberfläche
- kleine Polarisierbarkeit der e-
- hohe EN
Symbiotischer Effekt
Pearson postuliert, dass eine Kombination von hart/hart und weich/weich thermodynamisch eine günstigere Beziehung darstellt als diejenige der gemischten Paare. Es ist Fluorwasserstoff (HF) als
Folge der günstigen Kombination der harten Base Fluorid und dem harten Proton nur wenig dissoziert. Das Iodid-Ion als weiche Base bildet eine ungünstige Kombination mit dem harten Proton,
wodurch sich erklärt, dass Iodwasserstoff (HI) die stärkste unter den Halogenwasserstoffsäuren ist.
Dieses in der anorganischen Chemie nützliche Prinzip lässt sich entsprechend angepasst auf die organische Chemie und die nucleophile Substitution übertragen. Läuft beispielsweise
eine Reaktion nach einem monomolekularen SN1–Mechanismus ab, so nimmt die Eignung eines Nukleophils mit seiner Härte zu, da das Carbeniumion eine vergleichsweise harte Säure darstellt.
Nucleophile Substitution
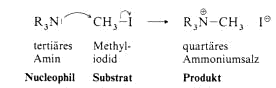
Das angreifende Reagens wird Nucleophil genannt, die austretende Gruppe Abgangsgruppe. Die ganze Reaktion bezeichnet man als Substitution, weil im Substrat das Iod durch R3N ersetzt wird, und genauer
als nucleophile Substitution, weil das Reagens ein Elektronenpaar in ein sp3-Orbital des C-Atoms hineindrückt und durch eine Atombindung an das C-Atom gebunden wird, während die Abgangsgruppe
ihr bindendes Elektronenpaar mitnimmt. Die nucleophile Substitution ist ein wichtiger Reaktionstyp bei der Umsetzung organischer Moleküle.
Bimolekulare nucleophile Substitution (SN2-Reaktion)
Bei dieser Reaktion reagiert ein Nucleophil mit einem Kohlenstoffatom, das eine partielle positive Ladung trägt, unter der Abspaltung eines Nucleophuges. Das Ergebnis der Reaktion ist somit eine
Substitution am Kohlenstoffatom unter gleichzeitiger Bildung einer Bindung zwischen dem Nucleophil und dem Kohlenstoffatom.
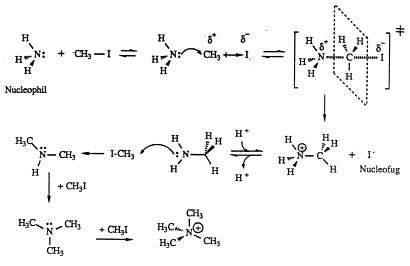
Warum setzten nicht alle Methylaminmoleküle die Reaktion fort?
› Vergleiche Füttern von Tauben: Die dicken Tauben fressen mehr, andere gehen leer aus. Hier ist es das Gleiche.
Übergangskomplex
Ein hypothetisches, energiereiches Molekül, welches mit dem kleinstmöglichen Energieaufwand aus den Edukten einer chemischen Reaktion gebildet wird und sich sowohl unter Rückbildung
der letzteren als auch unter Bildung der Produkte der Reaktion zersetzen kann.
Die vorher erwähnte nucloephile Substitution ist einstufig, d.h. es bildet sich bei der Transformation von den Edukten in die Produkte nur ein solcher Übergangskomplex.
Gleichzeitig ist die Reaktion aber auch bimolekular. Die Molekularität einer chemischen Reaktion ist die Zahl der Moleküle, welche an der Bildung des Übergangskomplexes beteiligt sind.
Kinetische Kontrolle
Eine Reaktion ist kinetisch kontrolliert, wenn die Zusammensetzung des Reaktionsgemisches von der Differenz der Energiegehalte der Übergangskomplexe, die zur Bildung verschiedener Reaktionsprodukte
führt, abhängt.
Eine mehrstufige Reaktion ist kinetisch kontrolliert, wenn mindestens ein Reaktionsschritt irreversibel ist. Die Geschwindigkeit der Gesamtreaktion wird in diesem Fall vom langsamsten Schritt bestimmt.
Eine kinetisch kontrollierte Reaktion läuft stets in Richtung der niedrigsten Aktivierungsenergie, während bei der thermodynamisch kontrollierten Reaktion das energetisch günstigere
Produkt gebildet wird.
Eine Reaktion ist thermodynamisch kontrolliert, wenn alle Reaktionsschritte reversibel sind. Die Zusammensetzung des Reaktionsgemisches hängt dann nur von der Grösse der Gleichgewichtskonstanten
der Reaktion ab, d.h. von der freigesetzten Energie.
Eine Reaktion ist irreversibel, wenn die Aktivierungsenergie der Rückreaktion mehr als 30 kcal/Mol beträgt.
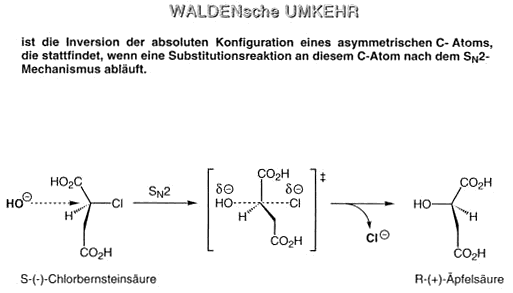
Waldersche Umkehrung ist die Umkehrung der absoluten Konfiguration eines asymmetrischen C-Atoms, die stattfindet, wenn eine Substitutionsreaktion an diesem C-Atom nach dem SN2-Mechanismus abläuft
Monomolekulare nucleophile Substitution
Neben der oben beschriebenen SN2-Reaktion gibt es einen alternativen Mechanismus der nucleophilen Substitution, der als SN1-Reaktion bezeichnet wird. Hier findet die Abspaltung des Nucleofugs vor der
Anäherung des Nucleophils statt. Eine derartige Reaktion ist jedoch nur möglich in sehr polaren Lösungsmitteln und wenn die Bindugsdissoziationsenergie des Nucleofugs klein ist.
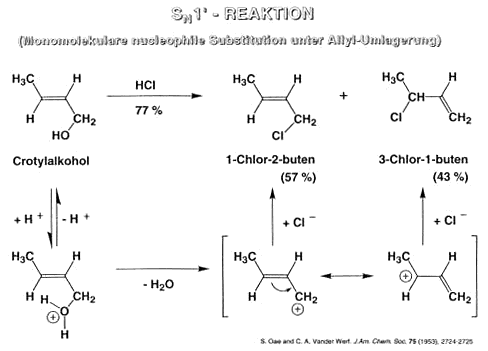
Die SN1-Reaktion ist nicht stereoselektiv (da ein Carbeniumion ausgebildet wird, das planar ist). Þwichtige für die Unterscheidung von SN1 und SN2.
Carbonylverbindungen
Carbonylverbindungen spielen in der organischen Chemie und Biochemie eine wichtige Rolle. Sie enthalten als funktionelle Gruppe die CO-Gruppe.
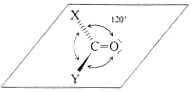
Anders als bei C=C-Doppelbindungen ist die C=O-Doppelbindung stark polarisiert. Das elektronegativere Sauersoffatom trägt eine negative Partialladung (d-), das Kohlenstoffatom eine positive Partialladung
(d-). Die Polarisierug wirkt sich stärker auf die p-Bindung als auf die s-Bindung aus, sie ist deshalb ausgeprägter als bei den Alkoholen, d.h. dass das Sauerstoffatom der CO-Gruppe leichter
ein Elektrophil (E+) anlagert und das Carbonyl-C-Atom leichter von einem Nucleophil (Nu-) angegriffen wird. Die Polarität, die den Begriffen “Nucleophil“ und “Elektrophil“ zugrundeliegt,
führt dazu, dass das Carbonyl-C-Atom auch als elektrophiles Zentrum und das Carbonyl-O-Atom als nucleophiles Zentrum bezeichnet wird
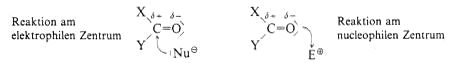
Greift ein Nucleophil am Carbonyl-C-Atom an, dann verschiebt sich das p-Elektronenpaar zumO-Atom hin, das ein Proton (Elekrophil) anlagert. Das C-Atom geht dabei von sp2- in den sp3-hybridisierten
Zustand über. In dieser Reaktion sind Aldehyde etwas reaktiver als Ketone.
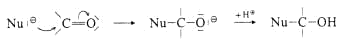
Nucleophile Addition
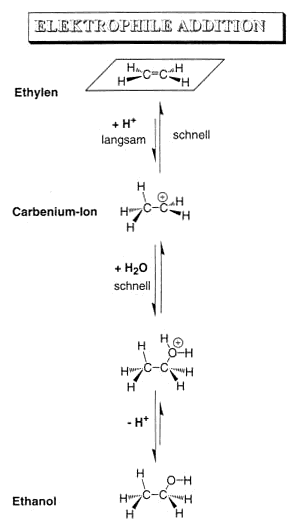
Unterschied nucleophile und elektrophileAddition Bei der elektrophilen Addition ist der langsamste Schritt die Protonierung und das Proton ist ein Elekrophil. Bei der nucleophilen Addition ist der langsamste Schritt die Hydratisierung. H2O ist ein
Nucleophil.
Die nucleophile Addition von Wasser, Alkoholen, Aminen und Carbanionen (Aldol-Kondensation) an die Carbonylgruppe kann sowohl durch Säuren als auch Basen kathalysiert werden. Diese vier Reaktionen
sind reversibel.
Ketol-Enol-Tautomerie
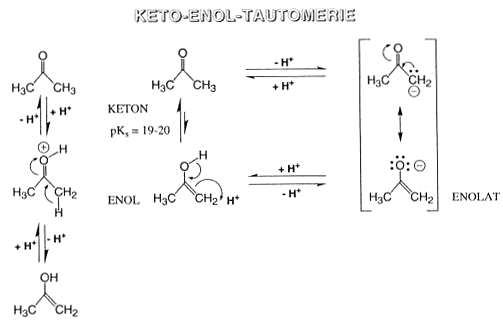
Die Polarisierung der Carbonylgruppe wirkt sich auch noch auf das benachbarte C-Atom aus, das als a-Atom bezeichnet wird. An ihm hängende H-Atome (a-ständige H-Atome) zeigen für C-H-Bindungen
ungewöhnliche Acidität (pKs=19-21 für Aldehyde und Ketone). In Gegenwart starker Basen bildet sich ein Anion, das mesomeriestabilisiert ist. Das freigewordene Elektronenpaar und die damit
verbundene negative Ladung sind zwischen dem a-C-Atom (Carbanion) und dem Carbonyl-O-Atom (Enolat-Ion) verteilt. Die Mesomerie stabilisiert das Anion, dies steigert in der Ausgangsverbindung die Tendenz
zur Protonenabgabe und ist somit die Ursache für die Acidität.
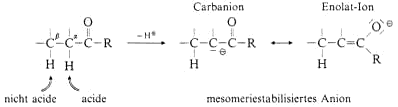
Das aus dem Aldehyd oder Keton gebildete Anion hat zwei Möglichkeiten, beim Ansäuern wieder ein Proton aufzunehmen: an das ursprüngliche a-C-Atom zur Ketoform oder am Enolat-O-Atom zur
Enolform. Der Name Enol weist auf die C=C-Doppelbindung („en„) und die OH-Gruppe („ol„) hin.
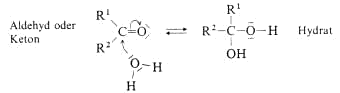
Keto- und Enolform stehen miteinander im Gleichgewicht. Es handelt sich um Konstitutionsisomere, die in diesem speziellen Fall Tautomere heissen.
Addition von Wasser und Alkoholen
Wasser greift das Carbonyl-C-Atom von Aldehyden und Ketonen an und gibt ein Proton an das Carbonyl-C-Atom ab. Formal addiert sich Wasser an die C=O-Doppelbindung, es entsteht ein Hydrat, das mit der
Ausgangsverbindung im Gleichgewicht steht

Analog dem Wasser reagieren auch Alkohole, dabei entstehen aus Aldehyden Halbacetale, aus Ketonen Halbketale.
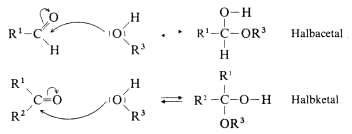
Zugabe starker Säuren (HCl, H2SO4) zur Mischung aus Aldehyd (Keton) und Alkohol katalysiert einerseits die Halbacetalbildung, im Anschluss daran jedoch auch die Folgereaktion. Unter Wasserabspaltung
entsteht aus dem Halbacetal (Halbketal) ein Carbeniumion, das von einem weiteren Alkohol-Molekül nucleophil angegriffen wird und nach Verlust eines Protons zum Acetal (Ketal) wird.
Addition von Aminen
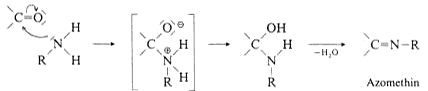
Ammoniak und Amine sind gute Nucleophile. Bei der Reaktion primärer Amine mit Aldehyden und Ketonen laufen im einzelnen folgende Vorgänge ab: Das Amin greift das Carbonyl-C-Atom nucleophil
an und bildet ein Zwischenprodukt (Zwitterion), das formal durch Verschiebung eines Protons vom N-Atom zum O-Atom in das eigentliche Additonsprodukt übergeht. Dieses ist nicht stabil, sondern eliminiert
unter Säurekatalyse leicht Wasser. Das Kondensationsprodukt heisst allgemein Schiffsche Base oder Azomethin
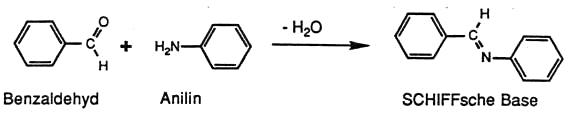
Imine sind im allgemeinen eher reaktionsfreudige Verbindungen. Das einfachste Imin, aus Formaldehyd und Ammoniak gebildet, polimerisiert unter den Bildungsbedingungen zu einer strukturell dem Adamantan ähnlichen
Verbindungen, dem Urotropin.
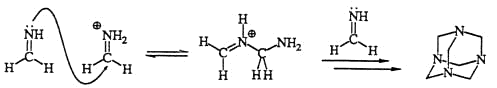
Reaktivität der Imine
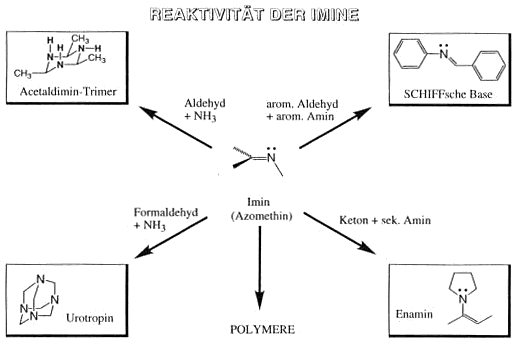
Reaktionen von Aldehyden und Ketonen mit sekundären Aminen bleiben zunächst auf der Stufe des Iminium-Ions stehen, da das Stickstoffatom über keine Wasserstoffliganden mehr verfügt,
welche als Protonen abgespalten werden könnten. Weist die ursprünglich eingesetzte Carbonylverbindung jedoch a-ständige Wasserstoffatome auf, so wird eines davon als Proton unter Bildung
eines Enamins abgespalten.
Aldol-Kondensation
In stark alkalischer Lösung dimerisiert Acetaldehyd zum Aldol, einer Verbindung, die je eine Aldehyd- (-al) und Hydorxygruppe (-ol) enthält. Formal ist ein Acetaldehyd-Molekül unter
Spaltung einer C-H-Bindung an die CO-Gruppe eines zweiten Moleküls Acetaldehyd addiert worden. Deshalb heisst dieser Teilschritt auch Aldol-Kondensation. Wie kommt es zu dieser Reaktion?
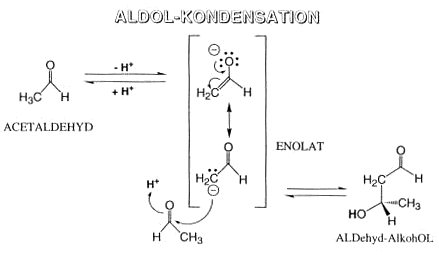
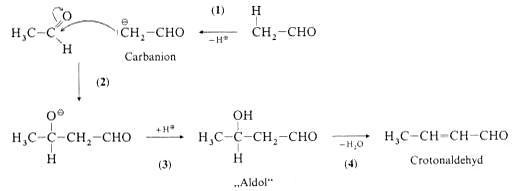
- Eines der aciden a-ständigen H-Atome des Acetaldehyds wird an die Base OH- abgegeben. Der deprotonierte Anteil ist gering (Gleichgewicht).
- Das mesomeriestabilisierte Anion ist ein besonders
reaktives Nucleophil. Es reagiert als Carbanion mit unverändertem Acetaldehyd.
- Die negative Ladung wird durch ein Proton aus dem Wasser ausgeglichen (das Alkoholat-Anion ist stärker
basisch als OH-). Das Aldol ist in der Regel instabil und wird beim Erhitzen oder nach Ansäuren der Lösung dehydratisiert. Es entsteht eine zur CO-Gruppe konjugierte C=C-Doppelbinung.
- Aus dem Additionsprodukt wird ein Kondensationsprodukt.
Konjugierte Addition
Ein konjugiertes System von Doppelbindungen verhält sich anders als ein Molekül, bei dem zwei oder mehr Doppelbindungen isoliert voneinander sind.
Dementsprechend weisen Carbonyl-Verbindungen, bei denen die Doppelbindung in Konjugation mit der CO-Gruppe steht (sogenannte a,b-ungesättigte Carbonyl-Verbindungen) eine charakteristische Reaktivität
auf.
Aufgrund der höheren EN des Sauerstoffatoms ist der Energiegehalt der Resonanzstruktur, bei der die Elektronen der C=C-Doppelbindung in die Carbonylgruppe delokalisiert sind, relativ gering, so
dass das gesamte Molekül am b-ständigen C-Atom mit Nucleophilen reagieren kann. Die Übertragung der charakteristischen Reaktivität der Carbonyl-Funktion auf das b-C-Atom der damit
konjugierten C=C-Bindung ist eine Konsequenz des sogenannten Vinylogie-Prinzips.
Vinylogie-Prinzip
Durch Konjugation einer funktionellen Gruppe mit einer oder mehreren C=C-Doppelbindungen wird die charakteristische Reaktivität der ersteren auf das entfernteste der Polyen-Kette übertragen.
Bei Vinyl-Gruppen, die an eine funktionelle Gruppe gebunden sind, weist in der Regel das b-ständige C-Atom die für die funktionelle Gruppe charakteristische Reaktivität auf
So reagieren a,b-ungesättigte Carbonyl-Verbindungen mit Nucleophilen (HO-, NH3, Amine, Enolat-Ionen, Carbanionen, ...) unter formaler Addition an die C=C-Doppelbindung (sog. konjugierte Addition).
Reaktionsmechanistisch handelt es sich jedoch um eine 1,4-Addition gefolgt von einer Tautomerisierung des primär gebildeten Enols.
Konjugierte (1,4)-Addition ® Michael-Addition (Analogie zur Vinyladdition
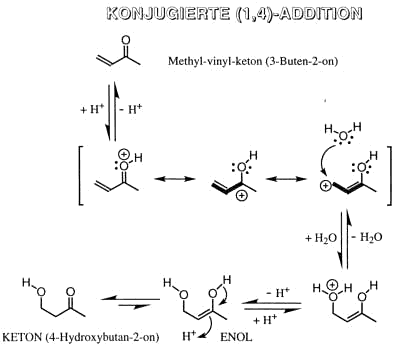
Fumarsäurereaktion
Wird Fumarsäure mit viel Wasser bei 150-200°C erhitzt, so erhält man Äpfelsäure. Da unter diesen Bedingungen Anlagerung von Wasser an die Doppelbindung eines Olefins (z.B. 2-Buten)
nicht stattfindet, ist der Mechanismus der Addition von Wasser an die Doppelbindung der Fumarsäure als nucleophile Addition zu formulieren:
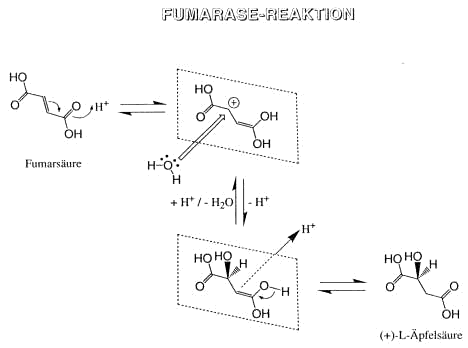
Ähnlich verhalten sich Chinone (®nicht aromatisch)
Chinone
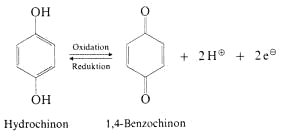
Hydrochinon (1,4-Dihydroxybenzol) ist ein zweiwertiges Phenol. Es ist ein gutes Reduktionsmittel und kann leicht zu einer gelben Verbindung oxidiert werden, die 1,4-Benzochinon heisst. Die Reaktion,
die hier abläuft, erfolgt unter Abgabe von 2 Protonen und 2 Elektronen, was der Abgabe von 2 H-Atomen entspricht. Der Begriff Oxidation ist in der Organischen Chemie gleichbedeutend mit Dehydrierung.
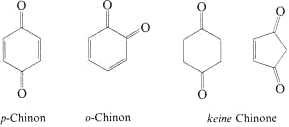
1,4-Benzochinon oder allgemein Chinone enthalten zwei CO-Gruppen, die in einem Sechsring durch konjugierte C=C-Doppelbindungen verknüpft sind. Man unterscheidet p-Chinone und
o-Chinone. Fehlen die konjugierten C=C-Doppelbindungen im Ring oder ist der Ring kleiner, liegen keine Chinone vor, sondern Ketone. m-Chinone existieren nicht!
Anellierte aromatische Ringe am 1,4-Benzochinon verändern den Chinoncharakter des ursprünglichen Ringsystems nicht, ebenso wenig wirken sich Substituenten am Ring aus.
Die wichtigste Eigenschaft der Chinone ist ihre Reduzierbarkeit zum Hydrochinon |
