Einfache Unterscheidungsmerkmale
Der Name „Säure“ kommt daher, dass bestimmte Stoffe, z.B. Zitronen oder saure Milch, einen sauren Geschmack hervorrufen, „Laugen“, später „Basen“, vom
scharfen, seifigen Geschmack von Seifenlaugen.
Wenn man Basen und Säuren vermischt, bildet sich ein Salz. Weiter färbt sich eine Säure mit Lackmus (Indikator) rot , eine Base hingegen mit demselben Stoff blau.
Säure | Base-Definitionen nach Brönsted
Wässrige Lösungen von Säuren und Salzen leiten elektrischen Strom. Diese gelösten Stoffe heissen Elektrolyte. Es müssen also Ionen vorliegen, die sich bei Säuren und
Basen erst in wässriger Lösung bilden und zwar durch Aufspaltung von kovalenten Bindungen, was man Dissoziation nennt.
- Chlorwasserstoff (Salzsäure) dissoziiert in Chloridionen und Wasserstoffionen, die jeweils hydratisiert sind.
- Natronlauge als Beispiel für eine Lauge dissoziiert in Natriumionen und
Hydroxylionen
Säuren geben Protonen ab, sind also Protonendonatoren.
Basen nehmen Protonen auf, sind also Protonenakzeptoren.
Säure/Base-Reaktionen sind Protonenübertragungs-Reaktionen (=Protolyse-Reaktion), da bei chemischen Reaktionen keine freien Protonen auftreten, es muss also immer ein
Stoff(Base) da sein, der das von der Säure abgegebene Proton aufnimmt.
Konjugierte Säure | Basepaare, Ampholyte
Protolysereaktionen sind reversibel. Folglich stellen sich Gleichgewichte ein.
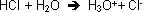
Wobei das Chloridion die konjugierte Base, und das Hydroniumion die konjugierte Säure darstellt. HCl / Cl- und H2O / H3O+ ist also ein Säure/Base-Paar.
Säuren, die bei der Dissoziation in Wasser mehr als ein Proton abgeben können, heissen entsprechend der zur Abgabe zur Verfügung stehenden Protonen „zweiprotonig“, „dreiprotonig“,
usw.. Bei solchen mehrprotonigen Säuren existieren mehrere Dissoziationsstufen, die nacheinander formuliert werden.
Namen und Formeln wichtiger Säuren und ihrer Anionen:
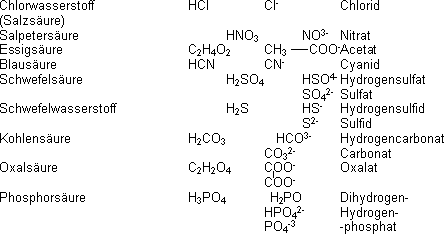
Eine Säure muss mindestens ein Proton abgeben können und eine Base mindestens ein freies Elektronenpaar besitzen, damit es das Proton anlagern kann.
Ein Spezialfall ist Wasser, das einerseits als Base, andererseits als Säure reagieren kann. (Es gibt noch andere amphotere Stoffe, wichtige sind die Aminosäuren, die saure und basische funktionelle
Gruppen im selben Molekül besitzen). Man nennt solche Stoffe amphoter, sie sind Ampholyte. Ob Wasser nun als Säure oder als Base reagiert hängt vom Reaktionspartner ab, bzw. von dessen Säuren-
oder Basenstärke.
Eigendissoziation von Wasser und pH-Wert
Wasser reagiert in geringem Ausmass mit sich selbst, was man Eigendissoziation oder Autoprotolyse nennt. Bei diesem Vorgang werden Ionen gebildet, die eine leichte elektrische Leitfähigkeit
nach sich ziehen, auch in reinem Wasser. Wenn man die Gleichgewichtskonstante K bestimmt, stellt man fest, dass das GGW weit auf der rechten Seite liegt. Dies sagt aus, dass Wasser nur in sehr geringem
Masse als Ionen vorliegt, was die Aussage, die Wasserkonzentration sei konstant, brauchbar werden lässt (1l = 55,6mol).
Man führt das Ionenprodukt Kw ein, welches die GGW-Konstante multipliziert mit der Wasserkonzentration, meint. Bei ungefähr 22° Celsius entspricht es 10-14 mol2/l2.
In neutraler Lösung liegen Hydroniumionen und Hydroxylionen in gleichem Masse vor. Folglich ist eine saure Lösung dadurch bestimmt, dass die Hydroniumionenkonzentration überwiegt, eine basische/alkalische
durch ein Übergewicht an Hydroxylionen.
Man hat also als Mass für die Acidität/ bzw.Basizität die Hydroniumionenkonzentration genommen, von dieser den negativen Zehnerlogharitmus und das als pH-Wert definiert:

angewandt auf das Ionenprodukt ergibt das:
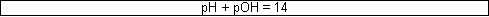
Anmerkung: (H3O+) wird auch als (H+) angegeben.
pH – Skala: reicht von pH =0 bis pH =14 (pH =7 Lösung ist neutral)
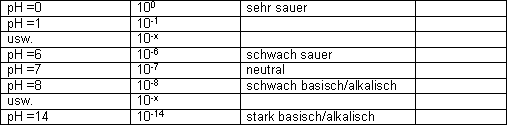
- Auch negative pH-Werte sind denkbar, sobald die Hydroniumkonzentration grösser als 1mol/l wird.
- Aktivitätskoeffizient f (0<f<1): Aktivitätskoeffizienten kommen werden
dann bedeutsam, wenn mit Lösungen, die konzentrierter als 0,1mol/l sind, gerechnet wird. Dann darf
man nicht mehr einfach die Konzentrationen anschauen, sondern muss die effektiven Aktivitäten anschauen. Aktivität a =f
Stärke von Säuren und Basen
Die Stärke einer Säure bzw. Base gibt an, wie vollständig die Protonenübertragung von der Säure auf das Wasser bzw. umgekehrt, von statten geht.
Um die Säuren bzw. Basenstärke zu definieren, betrachtet man die Dissoziationskonstanten einer Säure bzw. Base mit Wasser:
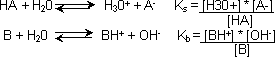
Ks und Kb sind also Säure- und Basenkonstante, wobei die Wasserkonzentration schon in die Konstanten einbezogen ist.
Wie schon für den pH-Wert nimmt man auch hier den negativen Zehnerlogarithmus, um die Zahlen handlicher zu machen. Folglich ist eine Säure mit einem kleinen pKs-Wert stark, solche mit einem
grossen schwach.

pKs und pKb hängen wie folgt zusammen:
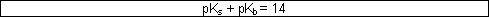
Diese Beziehung erlaubt es, dass man auch für Basen den pKs-Wert angeben kann, der sich eigentlich auf deren konjugierte Säure bezieht. Die pK-Werte müssen aus Tabellenwerken entnommen
werden, wobei die Säuren von oben nach unten in abnehmender Protonendonatorstärke aufgeführt sind.
Bei mehrprotonigen Säuren muss für jede Dissoziationsstufe der pKs-Wert angegeben werden, wobei man bemerken kann, dass sich das erste Proton immer leichter löst als das zweite, und
das wiederum leichter als das dritte (pKs1< pKs2< pKs3).
Starke Säuren reagieren mit Wasser praktisch vollständig zu H30+ und der konjugierten Base. H30+ ist die eigentliche Säure in wässriger Lösung, was den Schluss zulässt,
dass es keine stärkere Säure als das Hydroniumion in Wasser gibt.(Die pKs-Werte von HCl und Schwefelsäure wurden in einem anderen Lösungsmittel bestimmt.) Analog ist OH- die stärkste
Base in Wasser.
In welche Richtung läuft eine Protolyse ab?
Die Säure mit dem kleineren pKs-Wert (=stärkere Säure) gibt immer Protonen an die konjugierte Base des Säure-/ Basepaares mit dem grösseren pKs-Wert ab (=schwächere
Säure).
Die Säure mit dem kleineren pKs-Wert (=stärkere Säure) gibt immer Protonen an die konjugierte Base des Säure-/ Basepaares mit dem grösseren pKs-Wert ab (=schwächere
Säure).
Die stärkere Säure verdrängt die schwächere aus ihrem Salz. Der Protonenfluss geht immer von der stärkeren Säure zum Anion der schwächeren Säure.
Berechnung von pH-Werten
Starke Säuren reagieren praktisch vollständig zu H3O+ und ihrer konjugierten Base. Man darf daher annehmen, dass für jedes Teil Säure, das zu Beginn der Reaktion vorlag, ein
Teil H30+ gebildet wurde.( und natürlich ein Teil der konjugierten Base, was bei einer sauren Lösung aber weniger interessiert.!)
Allgemein für starke Säuren gilt:
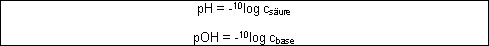
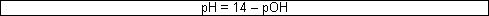
Beispiel: Man verdünnt eine Salzsäurelösung immer mehr und beobachtet, was mit dem pH-Wert passiert:
- 0.1M Salzsäure: csäure = 0.1mol/l; pH = 1
- 0.2M Salzsäure: csäure = 0.2mol/l; pH = 2
- 0.3M Salzsäure: csäure = 0.3mol/l; pH = 3
Je mehr man verdünnt, desto weniger sauer wird die Lösung werden. Einen pH-Wert grösser als 7 jedoch kann es beim Verdünnen einer Säure nicht geben ( bei pH = 7 ist ja [H30+]
= [OH-] ), da bei weiterem Verdünnen die Eigendissoziation des Wassers greift.
Bei schwachen Säuren hingegen darf man nicht davon ausgehen, dass alle Säure dissoziiert, was einen grösseren pH-Wert nach sich zieht, da weniger Hydroniumionen vorliegen. Die
Ausgangskonzentration der Säure ändert sich bei schwachen Säuren sogar so wenig, dass man die Veränderung vernachlässigen kann.
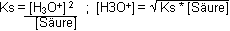
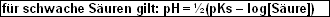

Messung von pH-Werten
Das Messen und Einstellen von pH-Werten ist insbesondere auch für die Medizin von grosser Bedeutung, weil das Blut einen pH-Wert von ziemlich konstant 7.35-7.45 haben muss.
Zwei Methoden stehen grundsätzlich zur Verfügung:
- Messung pH-abhängiger Potentiale mit Hilfe eines pH-Meters, das mit einer Glaselektrode oder einer pH-abhängigen Redoxelektrode verbunden ist.
- Messung mit Hilfe von Indikatoren
Indikatoren sind schwache org. Säuren oder Basen, die, wenn sie in Säuren oder Basen gegeben werden, ihre Farbe ändern.

Bsp: Lackmus ist, wenn es als Säure vorliegt rot (Hind), wenn es als Base vorliegt blau (Ind-). Wenn nun [Hind] = [Ind-], dann ist pH = pKInd .Es ergibt sich eine Mischfarbe; da das Auge aber
nur schwer Mischfarben auszumachen vermag, beschränkt man sich auf die optische Wahrnehmung der reinen Farbe von HInd oder Ind-.
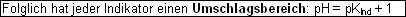
Das bedeutet, dass der Farbumschlag für das Auge erst deutlich ist, wenn die Konzentration von [HInd] zehnmal grösser ist als [Ind-].
Mit einem einzelnen Indikator ist die pH-Wertbestimmung nur sehr ungenau möglich, also braucht man mehrere Indikatoren, um den pH-Bereich immer weiter einschränken zu können. Es gibt
einen Universalindikator, der bei bestimmtem pH-Wert eine bestimmte Farbe annimmt und damit der pH-Wert ziemlich genau angegeben werden kann.
Neutralisation
Bei der Reaktion von Säuren mit Basen heben sich deren Eigenschaften ganz oder teilweise auf, denn die Protonen von der Säure werden von der Base aufgenommen. Diesen Vorgang bezeichnet
man als Neutralisation.
Bsp: Natronlauge reagiert mit Salzsäure. Die Reaktion formuliert man am besten als Ionenreaktion: H3O+ + Cl- + Na+ + OH- › Na+ + Cl- + 2H2O
Die eigentliche Neutralisations-Reaktion besteht darin, dass Hydroniumionen und Hydroxylionen zu weitgehend undissoziiertem Wasser zusammentreten.
H30+ + OH- › 2H2O ΔH° = -57.3 kJ/mol , Neutralisationswärme
Der freiwerdende Energiebetrag ist unabhängig davon, ob man starke oder schwache Säuren mit Hydroxydlösungen neutralisiert.
pH-Wert von Salzlösungen
Man bekommt einen pH-Wert = 7, wenn man äquimolare Mengen von beispielsweise Salzsäure und Natronlauge nimmt. Ein pH-Wert von 7 ist für eine Neutralisation hingegen nicht zwingend,
war hier nur der Fall, weil das Salz aus der Neutralisation einer starken Base mit einer starken Säure hervorgegangen ist.
Die Neutralisation einer starken Säure mit einer schwachen Base führt zu einem pH-Wert > 7, weil ein Teil der Base mit ihrer konjugierten Säure im GGW steht. Analog: Neutralisation
einer schwachen Säure mit einer starken Base è pH-Wert < 7.
Der pH-Wert einer Lösung, in der eine Neutralisation durchgeführt wurde, kann sehr deutlich vom Neutralpunkt ( pH = 7 ) abweichen.
Neutralisation bedeutet lediglich, dass äquimolare Mengen Säure mit Base zur Reaktion gebracht wurden.
Säure- | Base-Titration
Als Titration bezeichnet man die allmähliche Zugabe von einer Base zu einer Säure.
Bsp.: Versetzt man die zu titrierende Säure, 10ml 0.1M HCl, nacheinander mit jeweils 1ml NaOH und misst nach jeder Zugabe den pH-Wert, erhält man eine sogenannte Titrationskurve. Nach
Zugabe der äquimolaren Menge NaOH, also 10ml, wird der Äquivalenzpunkt erreicht; das heisst es ist die anfänglich Menge HCl vollständig mit NaOH neutralisiert worden. Vor dem Äquivalenzpunkt
bestimmt die Säure, nachher die Base den pH-Wert der Lösung.
pH-Sprung : Als pH-Sprung bezeichnet man den steilen Anstieg in der Titrationskurve kurz vor und kurz nach dem Äquivalenzpunkt (wenn bereits 99% der anfänglichen Menge der Säure neutralisiert
wurde, steigt der pH-Wert „sprungartig“ an).
Gehaltsbestimmung
Die bei einer Titration zugegebene Säure oder Base bezeichnet man als Titrationsmittel. Wenn dessen Konzentration bekannt und der Äquivalenzpunkt bestimmbar ist, kann der Gehalt an Säure
oder Base in der vorliegenden Lösung bestimmt werden. (Der Äquivalenzpunkt kann mit Hilfe eines Indikators bestimmt werden, wobei darauf zu achten ist, dass der Umschlagbereich des Indikators
in den pH-Bereich des stark ab- oder ansteigenden Kurvenastes der Titrationskurve fällt.)
Wenn eine zwei- oder dreiprotonige Säure bzw. mehrbasige Base vorliegt, muss beachtet werden, dass beispielsweise 1mol von H2SO4 insgesamt 2mol H3O+-Ionen freisetzt. Wenn man den Gehalt einer
Lösung mit einer mehrprotonigen bzw. mehrbasigen Säure bzw. Base bestimmen will, muss man also einen Faktor, hier 2, berücksichtigen. Zu diesem Zweck verwendet man anstatt Molarität
manchmal Normalität.
Def.: Eine 1N Lösung enthält die Äquivalentmasse der Säure bzw. Base in Gramm in einem Liter.
Die Äquivalentmasse ist die Molmasse geteilt durch die Anzahl der Protonen oder OH-Ionen, die ein Stoff insgesamt bei einer Neutralisation zur Vefügung stellt.
Gleiche Volumina gleichnormaler Lösungen einer Säure und einer Base neutralisieren sich somit vollständig. (Wertigkeit heisst, wieviele Protonen eine Säure bzw. Base abgeben oder
aufnehmen kann)
Normalität = Wertigkeit * Molarität
|
