Es gibt in der Chemie Säure-Basen-, Fällungs-, Redox- und Komlexbildungsreaktionen.
Was für Grundsätze/Prinzipien müssen bei einer chemischen Reaktion eingehalten werden?
- Erhaltung der Masse: Gleichviele Atome in Reaktanden und Produkten (Stöchiometrie )
- Erhaltung der Ladung: Summe der Ladungen der Produkte – Summe der Ladungen der Reaktanden = 0
Was ändert sich bei einer chemischen Reaktion?
- Umgebung der einzelnen Atome ( Bindungsverhältnisse ).
- Die Oxidationszahl der Elemente
1. und 2.
sind oft gekoppelt.
Chemisches Gleichgewicht, Massenwirkungsgesetz:
Ideal wäre es , wenn keine Wechselwirkungen zwischen den gelösten –Teilchen wirken würden.
Die Aktivität ist die Konzentration * Aktivitätskoeffizient, welcher immer kleiner als 1 ist.
Das Prinzip von Le Chatelier besagt, dass Gleichgewicht so reagiert , dass die Störung vermindert ist („Flucht vor dem Zwang“).
Energetik chemischer Reaktionen
Es gibt verschiedene Formen von Energie.
- Mechanische: potentielle, kinetische: E = mv2/2
- Wärmeenergie: Kinetische Energie der Atome und Moleküle
- Elektrische Energie: Spannung * Strom * Zeit = Ws = J
- Licht: E = h * n, z.B. Photosynthese
Enthalpie, H:
Die Enthalpie ist die Reaktonswärme bei T = konstant ( 298K ) und p = konstant ( 1bar ).
Die Enthalpie der Elemente ist null bei oben genannten Standardbedingungen.
Das Vorzeichen wird negativ gewählt, wenn das System Wärme an die Umgebung abgibt.
Satz von Hess:
Die Enthalpie einer Reaktion ist unabhängig vom Reaktionsweg, somit ist H eine Zustandsfunktion.
Entropie S:
Die Entropie S ist ein Mass für die Unordung eines Systems. S ist ebenfalls eine Zustandsfunktion. Hier wird das Vorzeichen positiv gewählt, wenn die Unordung zunimmt.
Freie Energie G:
Die freie Energie G ist ein Mass für die Triebkraft einer Reaktion.


Gekoppelte Reaktionen: Reaktionssequenzen 
Fliessgleichgewichte:

Salzlösungen:
- Gitterenergie ist die Energie, die frei wird, wenn das Gitter gebildet wird.
- Dissoziation: Coulomb Wechselwirkung wird durch grosse Dielektrische Konstante (H2O = 80 ) kleiner.
- Hydratation: Dipol H2O: Kation-OH2, Anion-H2O. Hydratationsenthalpie von Ionen (exotherm)
proportional zu 1/rion und proportional (Ladung)2 Grössenordung: n*100 – n*1000 kJ/mol.
- Lösungswärme: Bilanz von Gitterenergie und Solvationsenergie
- Grösse der aquatisierten Ionen: Li+>Na+>K+(im Gegenteil zu den nichtaquatisierten Ionen.
Löslichkeitsprodukt Lp oder Kso:
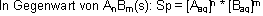
Fällungsreaktionen:
Wenn das Lp überschritten wird, fällt es aus.
Auflösung von Niederschlägen: Wenn das Lp unterschritten wird, indem man einen Reaktionspartner aus dem Gleichgewicht entfernt.
- Anion durch Protonierung
- Mn+aq durch Komplexbildung
- Anion oder Kation durch eine Redox-Reaktion
Elektolyt:
Stoff,der beim Auflösen in Ionen zerfällt.(Salze, starke Säuren)
Die elektrische Leitfähigkeit in idealer (unendlich verdünnter) Lösung nimmt linear mit der Konzentration zu.
Elektrolyse: Die Leitung von Gleichstrom durch Ionenbewegung in Elektrolytlösungen und in Salzschmelzen führt an der Kathode zu Reduktion, an der Anode zu Oxidation.
1 Faraday = 1.6*10-19*6*1023/mol = 96500 As/mol |
