Oxidation = Abgabe von Elektronen
Reduktion = Aufnahme von Elektronen
Die Koppelung der Oxidation mit der Reduktion ergibt die Redox-Reakton.
Oxidationsmittel = Elektronenakzeptor
Reduktionsmittel = Elektronendonator
Die Teilprozesse der Redox-Reaktionen sind umkehrbar. In welcher die Reaktion freiwillig abläuft, hängt von der Oxidations- bzw. Reduktionskraft des Partners ab.
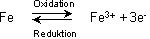
Oxidationszahlen

Die Oxidationszahlen innerhalb eines Moleküls ergänzen sich zu Null, bei komplexen Ionen zur Ladung des Ions.
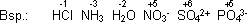
Halogene wie z.B. Chlor (Cl2) sind gute Oxidationsmittel. Dies wird beim Chlor z.B. ausgenutzt, um Wasser zu desinfizieren, weil es durch seine Oxidationseigenschaft Bakterien abtötet.
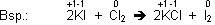
Cl2 oxidiert das I- (=Iodid), K+ ist am Redoxprozess nicht beteiligt.
Chlor hat eine stärkere Oxidationskraft als Iod. Dies verläuft bei den Halogenen parallel zur Elektronegativität. Chlor ist elektronegativer als Iod und entreisst I- die Elektronen. Demzufolge
ist Fluor das stärkste Oxidationsmittel überhaupt.
Je elektronegativer ein Element, ein desto stärkeres Oxidationsmittel ist es!
Elektrochemie
Elektrochemische Zellen
Eine elektrochemische Zelle besteht aus zwei metallischen Leitern (Elektroden), die mit einem elektrisch leitenden Medium (Elektrolyt), in Kontakt stehen.
- Galvanische Zellen: Die spontane chem. Reaktion wird zur Stromerzeugung genutzt (Blitzlichtbatterien, Bleiakkumulatoren in Kraftfahrzeugen, Lithium-Zellen in Herzschrittmachern).
- Elektrolyse-Zellen:
Mit Hilfe eines elektrischen Stromes wird eine nichtspontane Reaktion angetrieben.
Wichtig für alle elektrochemischen Zellen:
- Elektronen fliessen im externen Stromkreis von der Anode zur Kathode.
- Die Oxidation erfolgt an der Anode und Anionen bewegen sich in der Zelle zur Anode hin.
- Die Reduktion erfolgt an der Kathode und Kationen bewegen sich in der Zelle zur Kathode hin.
Galvanische Zellen
Bsp.: Zinkstab in wässriger Kupfer(II)sulfat Lösung.
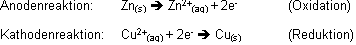
Metallisches Kupfer schlägt sich an der Zinkoberfläche nieder und ein Teil des Zinkes reagiert. (Kupfer wird reduziert und Zink oxidiert!)
Trennen wir nun Zinkstab und Kupferlösung voneinander, läuft dieselbe Reaktion ab, aber die Elektronen können die Cu2+-Ionen nur über den externen Stromkreis erreichen.
In dem Masse wie Cu2+-Ionen in einem Raum zu neutralem Cu und Zn-Atomen im anderen Raum zu Zn2+-Ionen umgewandelt werden, müssen sich Sulfationen bei einer CuSO42—Lösung zwischen den
beiden Räumen bewegen (durch eine poröse Wand), um die elektrische Neutralität aufrechtzuerhalten und den Stromkreis zu schliessen.
Die Reaktion erzeugt damit einen echten Strom von Elektronen – einen elektrischen Stromfluss – durch den externen Draht. Daniell-Element
› Behälter mit zwei Elektroden (Metall, Graphit) in Elektrolyt (wässrige Lösung von Ionen)
› Die beiden Räume werden mit einer Salzbrücke verbunden.
Salzbrücke
= umgekehrtes U-Rohr
konz. Salz (Kaliumchlorid od. Kaliumnitrat) in einem Gel
= Stromschlüssel ð erlaubt Ionenbewegung und schliesst Stromkreis
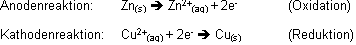
Weil die Elektronen die Zelle an der Anode verlassen, hat man sie als Minuspol (-) der galvanischen Zelle definiert. (Kathode = Pluspol (+))
Elektronen verlassen eine galvanische Zelle an der Anode (-), fliessen durch den äusseren Stromkreis und treten an de Kathode (+) wieder in die Zelle ein. Die Elektronen entstehen bei der Oxidation
an der Anode; nachdem sie den äusseren Stromkreis durchlaufen haben, bewirken sie an der Kathode eine Reduktion.
Umkehrung des Daniell-Elements = Elektrolyse
Das Diagramm einer galvanischen Zelle schreibt man so, dass die positive Elektrode (die Kathode, das Eingangstor der Elektronen in die Zelle, der Ort der Reduktion) rechts steht. Eselsbrücke:
r wie rechts und Reduktion.
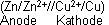
Elektromotorische Kraft (EMK)
Voraussetzung dafür, dass zwischen zwei Halbzellen im äusseren Draht Elektronen fliessen, die elektrische Arbeit leisten, ist eine Spannungsdifferenz (Potentialdifferenz ∆E), die der
elektromotorischen Kraft (EMK) der Zelle entspricht!
Die Beziehung zwischen E und ∆G lautet für eine Reaktion, bei der sich z mol Elektronen von der Anode zur Kathode vewegen:


(Nur bei neg. ∆G-Werten ist die Reaktion exergon, läuft also freiwillig ab, dazu muss ∆E positiv sein.)
Elektrodenpotentiale
Halbzellen verschiedener Metalle unterscheiden sich in ihrem Potential.
Dies hängt u.a. ab vom:
› der Elektronenkonfiguration der Metallatome
› vom Aufbau des Metallgitters
› von der Hydratation der Ionen im Elektrolyt
Elektronenpotential an der Metalloberfläche:
positiv: Wenn an der Metalloberfläche Metallionen an das Metallgitter angelagert werden.
negativ: Wenn Metallionen das Metallgitter verlassen.
Wir könne jedoch nur Potentialdifferenzen und nicht das absolute Potential messen ð Referenz-Halbzelle (=Bezugselektrode).
Gibt uns für sämtliche Halbzellen die Potentialdifferenz zur Bezugselektrode.

Normalwasserstoffelektrode (=Bezugs-Halbzelle):
Bei der Normalwasserstoffelektrode handelt es sich um das H+/H2-Redoxpaar im Standardzustand (H+-Ionen in der Konzentration vom 1 mol/L in Wasser und Wasserstoffgas bei 1.013 bar in der Gegenwart
einer Platinelektrode:
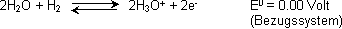
Bringt man diese Bezugshalbzelle mit anderen Halbzellen in Kontakt, dann kann der Elektronenfluss im äusseren Draht in 2 Richtungen erfolgen:
- Elektronen fliessen von der Mormalwasserstoffelektrode
zur andern Halbzelle (z.B. vom H2 zum Cu2+) ð Potential = positiv (+0.35V).
- Elektronen fliessen von der anderen Halbzelle zur Normalwasserstoffelektrode (Z.B. vom Zn zum H3O+) ð Potential
= negativ (-0.76V).
Spannungsreihe
In der elektrochemischen Spannungsreihe schreibt man die Redoxpaare nach ihren Normalpotentialen geordnet untereinander. Das angegebene Potential E0 mit seinem Vorzeichen bezieht sich immer auf den
Reduktionsprozess einer Teilreaktion. (Das Oxidationspotential ist immer gleich dem negativen Reduktionspotential.)
Nernstsche Gleichung
Halbzellen, die nicht den Standardbedingungen entsprechen, haben ein Potential E, das von E0 verschieden ist.
E hängt von der Konentration an oxidierter Form (Ox) und reduzierter Form (Red) in der Elektrodenlösung ab.

pH-Abhängigkeit von Redoxpotentialen
Wenn bei der Bildung der oxidierten Form eines Redoxpaares zugleich Protonen freigesetzt werden (in Wasser H3O+), ist das Potential der Halbzelle u.a. auch von der Hydroniumkonzentration, d.h. vom
pH-Wert der Lösung abhängig.
Glaselektrode
Heute werden pH-Messungen überwiegend mit der Glaselektrode ausgeführt. Die Glaselektrode, eine dünnwandige Glaskugel, die mit einem Elektrolyten gefüllt ist, zeigt eine Potentialabhängigkeit,
die dem pH-Wert proportional ist. Man benutzt sie normalerweise zusammen mit einer Kalomelelektrode (=Quecksilber-Iod-chlorid), die mit der Probelösung über eine Salzbrücke in Kontakt
steht.
Das Zellpotential wird gemessen und direkt als pH-Wert der Lösung angezeigt.
Im Innern der Glaskugel hält man den pH-Wert durch eine Pufferlösung konstant und bringt dann eine geeignete Ableitelektrode an – so kann man mit Hilfe der äusseren Elektrode (Bezugselektrode)
deren Potential nicht pH-abhängig ist, das Potential an de Glasmembran messen. Man eicht den pH-Meter mit einem Phosphatpuffer bekannten pH-Wertes und die gemessene Potentialdifferenz ist dann
dem pH-Wert der Messlösung proportional.
Knallgasreaktion und Atmungskette
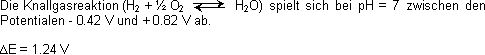
Energie die frei wird:
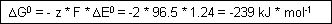
Bei allen Lebewesen, die Sauerstoff zur Energieversorgung benötigen, wird die Energie aus dem Potentialgefälle der Knallreaktion gewonnen.
In der Zelle kommt Wasserstoff nicht frei vor, sondern wird von organischen Substraten z.B. auf NAD+ (Nicotinamid-adenin-dinucleotid) übertragen.
Es entsteht NADH = eigentlicher Elektronendonator in der Atmungskette, die in den Mitochondrien abläuft.
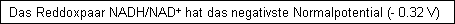
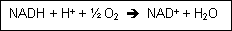
Bei der Oxidation von 1 mol NADH werden z mol ATP (Adenosintriphosphat) gebildet.
(ATP ist die für den Stoffwechsel wichtigste energiereiche Verbindung.) |
