Bedeutung für den Stoffwechsel
Die Konstanz eines bestimmten pH-Wertes ist im Körper sehr wichtig. Im Blut herrscht zum Beispiel ein anderer pH-Wert als im Magen oder im Darm. Der pH-Wert spielt für die Aktivität von
Enzymen beispielsweise eine wichtige Rolle. Da im Stoffwechsel viele Reaktionen ablaufen, bei denen H3O+ entsteht, ist es wichtig, dass die Zellflüssigkeiten in der Lage sind, solche pH-Stösse
aufzufangen, zu puffern.
Puffersubstanzen und ihre Wirkung
Pufferlösungen müssen also Stoffe enthalten, die es ermöglichen, dass der pH-Wert bei Zugabe einer Säure oder Base, nur sehr gering ändert.
Geeignete Puffersubstanzen:
- Das Gemisch aus einer schwachen Säure und dem Alkalisalz dieser Säure
- Das Gemisch aus einer schwachen Base und dem Salz dieser Base
Ein äquimolarer 0.2molarer Acetatpuffer beispielsweise bedeutet, dass in 1l einer Lösung 0.1mol der Essigsäure und 0.1mol des Natriumacetats enthalten sind.
Was passiert also, wenn man in eine Pufferlösung eine Säure oder eine Base gibt?
Entstehen H3O+-Ionen, übernimmt das Acetat diese, treten OH-Ionen auf, übernimmt die Essigsäure diese.
In beiden Fällen entsteht neutrales Wasser, daneben entweder Essigsäure oder deren Anion, die ja ohnehin schon in der Lösung vorlagen.
Puffergleichung
Um auf die Puffergleichung zu kommen, schaut man zuerst das Dissoziationsgleichgewicht der Säure des Puffers an.
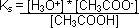
Dann löst man diese Gleichung nach der [H3O+] auf und bildet den –10log. So erhält man die Puffergleichung (Henderson-Hasselbalch-Gleichung), die wiefolgt lautet:
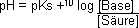
Liegen gleiche Mengen Säure und Anion vor (des Pufferpaares), fällt der log-Ausdruck weg, da Gleiches dividiert durch Gleiches 1gibt, und der Logarithmus von 1 O ist. In diesem Fall gilt pH
= pKs.
Ist das Konzentrationsverhältnis ungleich 1, bewirkt erst ein zehnfacher Überschuss des einen Partners über den anderen eine pH-Wert-Änderung um eine pH-Einheit.
Pufferkapazität
Wichtig sich zu merken ist, dass der pH-Wert auch beim Verdünnen der Pufferlösung konstant bleibt.
Was hat sich aber konkret beim Verdünnen geändert?
Bsp: 0.2M Acetatpuffer ( pH = 4.8 ) wird um den Faktor 10 verdünnt auf einen 0.02M Acetatpuffer ( pH = 4.8 ). Zuertst betrachtet man den 0.2M Puffer; 0.2M Acetatpuffer bedeutet, dass 0.1mol/l Essigsäure
und 0.1mol/l Acetat vorliegen. Jetzt gibt man 10ml 1M HCl hinzu. Was geschieht?

„0.1 – 0.01“ kommt daher, dass HCl, dessen Menge beim Zugeben 0.01mol beträgt, folglich 0.01mol des Acetat mit HCl reagieren. Die Menge Acetat hat sich von 0.1 auf 0.09 gesenkt.
Im Gegenzug aber hat sich 0.01mol mehr Essigsäure gebildet, nämlich 0.1 + 0.01.
Wie man ausgerechnet hat, ändert sich der pH-Wert nur sehr wenig.
Wenn man nun den 0.02M Puffer anschaut, stellt man fest, dass bei Zugabe von 0.01mol HCl – wie vorher – die gesamte Menge Acetat in Essigsäure überführt wird.
Es liegen nach der Zugabe von HCl also 0.02mol Essigsäure vor und kein Acetat mehr. Der pH-Wert von Essigsäure beträgt 3.25. Die Säure hat den Puffer erschlagen, weil zuviel an Säure
zugegeben wurde im Verhältnis zu den Konzentrationen des Puffers.
Gleiche Volumina verschieden konzentrierter Pufferlösungen unterscheiden sich in ihrer Pufferkapazität.
Die Pufferkapazität ist definiert als diejenige Menge einer Säure oder Base, die gebraucht wird, um den pH-Wert von 1 l der Pufferlösung um eine Einheit auf der pH-Skala zu verändern.
Bei einem 0.2M Acetatpuffer müsste man z.B. 0.9mol Essigsäure hinzufügen, beim 0.02M Acetatpuffer nur 0.09mol Essigsäure,um den pH-Wert auf 3.8 zu bringen, das entspricht genau einem
zehnfachen Überschuss der [Säure] auf die [Base].
pH-Optimum und Pufferbereich
Optimal ist eine Pufferlösung, wenn die Puffersubstanzen äquimolar vorliegen. Dann ist nämlich pH = pKs.

Die benötigte Pufferkapazität bestimmt die Konzentration und das Volumen der Pufferlösung.
In der Praxis muss meistens ein bestimmter pH-Wert konstant gehalten werden, aufgrund dessen man anhand der pKs-Werte den geeigneten Puffer auswählt.
Bei einer Titrationskurve erreicht man nach Zugabe der äquimolaren Menge einer Base zu einer in Lösung vorliegenden Säure den Äquivalenzpunkt.
Nach Zugabe der Hälfte der äquimolaren Menge entspricht [Säure] = [Base] (!), was auch bedeutet, dass dort pH = pKs gilt. Dieser Punkt liegt im flachen Kurventeil, das heisst, dass sich
bei weiterer Zugabe von Base der pH-Wert nur unwesentlich verändern wird ( bis zum pH-Sprung ).
Um also den Pufferbereich zu bestimmen, kann man experimentell die Titrationskurve ermitteln, und so den Pufferbereich einfach „ablesen“.
Kohlensäurepuffer - wichtige Bedeutung für den Körper
CO2 ( Endprodukt bei Verbrennung organischer Verbindungen) löst sich ziemlich gut in Wasser, welches dadurch leicht sauer wird.
Die zwei wesentlichen Reaktionen, die ablaufen:
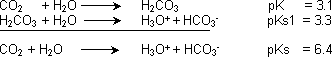
PK = 3.1 bedeutet, dass das GGW weit links liegt. Es liegt also vorwiegend CO2 vor. Die erste Reaktion ist mit der zweiten gekoppelt, daher dürfen die pK-Werte zusammengezählt werden, und
man stellt fest, dass das System CO2/H2O eine schwache Säure ist.
Man kann also ein Puffersystem mit Kohlendioxid und beispielsweise Natriumcarbonat mit einem pH-Optimum von 6.4 aufbauen ( = pKs ).
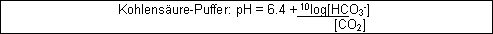
Dieser Puffer ist wichtig, weil er mithilft den pH-Wert des Blutes bei 7.4 zu halten. Dabei liegt er im Verhältnis von 10:1 vor. ( Erinnerung: um den pH-Wert um eine Einheit zu verändern müssen
die Puffersubstanzen – vgl. auch Indikatoren - im Verhältnis 10:1 vorliegen ).
Wie schon erwähnt sind pKs-Werte temperaturabhängig, was für den Kohlensäurepuffer bei Körpertemperatur ( 37° ) anstatt 6.4 nur 6.1 bedeutet.
Um dieses Manko zu beheben, liegt er im Verhältnis 20:1 vor, also mit sehr grossem Überschuss an Hydrogencarbonat. Der Puffer wirkt vor allem gegen H30+-Ionen, die im Stoffwechsel reichlich
entstehen.
CO2 ist ein Gas: seine Konzentration hängt folglich vom Partialdruck ab. CO2 wird in der Lunge mit der Atemluft abgegeben, das heisst, dass der Partialdruck und somit auch das Puffersystem durch
die Atmung rasch und effizient reguliert werden. Dadurch werden in gleicher Menge H3O+-Ionen beseitigt.

Der Kohlensäurepuffer ist ein „offenes Puffersystem“:
Einerseits können Kohlendioxidmoleküle durch das Atmen abgegeben werden, andererseits aber wird es als Stoffwechselendprodukt der Zelle ständig an das Blut abgegeben. Das hat zur Folge,
dass [CO2] und [HCO3-] im Blut konstant gehalten werden können. Wenn das nicht mehr der Fall ist, liegen Störungen im Säure-/ Basehaushalt vor.
Verstärkte Säurebildung im Stoffwechsel beispielsweise müssen durch eine verstärkte Atemtätigkeit kompensiert werden, damit der pH-Wert konstant bleibt.
Verstärkte Atemtätigkeit (Hyperventilation) ohne Säurebildung führt zu einem Anstieg des pH-Wertes im Blut: respiratorische Alkolose. Bei verminderter Atmung , verminderter Abgabe
von CO2, resultiert eine respiratorische Acidose. |
