Ein Stoff kann in fester, flüssiger und gasförmiger Form vorliegen.
Gas:
In einem Gas liegen die Teilchen in schneller Bewegung vor, die keine gegenseitige Anziehung aufeinander auswirken. Dafür führen sie elastische Stösse untereinander und mit der Wand
beim Aufprall aus. Die Stösse der Teilchen an der Wand, zum Beispiel in einem Gefäss, manifestieren sich im Druck..
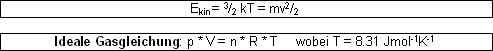
(R ist auch in 8.31 Pa*m3mol-1K-1 , oder 0.0831 bar*dm3mol-1K-1)
Wenn man ein Gas als ideal anschaut, wird dem Teilchen kein Eigenvolumen zugeschrieben und die Anziehungskräfte vernachlässigt. Reale Gase aber haben ein Volumen und es wirken auch Anziehungskräfte zwischen ihnen (alle Gase sind bei tiefer Temperatur flüssig)
Ein Gas übt, wie schon erwähnt, einen Druck aus. Der Partialdruck einer Komponente eines Gases ist der Druck, den die Komponente ausüben würde, wenn es alleine das gesamte Volumen
ausfüllen würde.
Flüssigkeit:
In einer Flüssigkeit herrschen Anziehungskräfte zwischen den Teilchen ( van der Waals ). Sie sind ebenfalls in schneller Bewegung und führen elastische Stösse aus. Das Teilchenvolumen
entspricht ungefähr dem Flüssigkeitsvolumen.
Wichtige Stichworte:
- Wasser ist ein gewinkeltes Molekül mit einem Winkel von 105° (weicht vom Tetraederwinkel aufgrund der zwei freien Elektronenpaare ab).
- Das Wassermolekül ist ein Dipol.
- Die Energie von Wasserstoffgruppen ist ungefähr 20kJmol-1.
- Wasser weist eine Dichteanomalie auf, das heisst, dass Wasser im festen Zustand in Wasser in flüssigem Zustand schwimmt.
- Oberflächenspannung, Kapillarkräfte.
Festkörper:
Alle Salze und Metalle sind kristallin: geordneter und anisotroper Zustand.
Unterkühlte Flüssigkeiten, Glas und Plastik haben eine amorphe Struktur.
Ein Stoff im festen Zustand kann verschiedene Kristallgitter aufweisen. Dies ist zum Beispiel der Fall bei den Elementen C, P, S, Sn, SiO2 etc.
Neben kristallinen Feststoffen kennt man amorphe Feststoffe. Bei ihnen besitzen die Teilchen keine durchgehend regelmässige Anordnung, damit fehlt ihnen auch eine regelmässige äussere
Form.
Phase
Eine Phase ist ein homogenes Gebiet der Materie. Phasenumwandlungen können entweder endo- oder exotherm ablaufen. Schmelzen und Verdampfen sind endotherme Umwandlungen, wobei Kondensieren ein
exothermer Vorgang ist.
Beim Schmelz- und Siedepunkt stehen zwei Phasen im dynamischen Gleichgewicht, man spricht von der Koexistenz zweier Phasen!
Phasendiagramm:
Das sogenannte Phasendiagramm zeigt wie die drei Aggregatszustände von Druck und Temperatur abhängen. Am Tripelpunkt sind alle drei Aggregatszustände vorhanden.
Der Dampfdruck ist eine f (T). Die Kurven im Diagramm steigen exponentiell.
Reiner Stoff
Ein reiner Stoff ist charakterisiert durch die chemische Formel. Seine intensiven Eigenschaften sind unabhängig von der Menge, seine extensiven Eigenschaften hingegen sind proportional der
Menge.
Intensive Eigenschaften: unabhängig von der Menge
Extensive Eigenschaften: proportional der Menge (additiv)
Gemisch
Es gibt homogene und heterogene Gemische. Homogen bedeutet, dass beliebig kleine makroskopische Bereiche dieselben intensiven Eigenschaften haben.
Heterogen bedeutet, dass es Teilbereiche gibt mit unterschiedlichen intensiven Eigenschaften.
Kolloide
Teilchen ca. zwischen 3 und 200 nm
Massenwirkungsgesetz
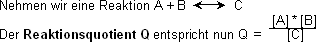
Wenn ein Gleichgewicht herrscht, wird Q auch als K (Gleichgewichtskonstante) bezeichnet, bzw. Q = K. Diese Gleichgewichtskonstante ist temperaturabhängig.
Heterogene Gleichgewichte
- Ohne Lösungsmittel: Stoff ist in zwei Phasen, entweder g + l oder g + s! Dann entspricht die Gleichgewichtskonstante K dem Druck des Gases von dem heterogenen
Gleichgewicht, denn die kondensierte Phase tritt im Gleichgewicht nicht auf.
- Verteilung unter Beteiligung von Lösungsmitteln: Wenn eine gesättigte Lösung vorliegt, tritt ein Stoff
in zwei Phasen auf, nämlich in flüssiger Phase, die in Lösung
gegangen ist, und in fester Phase, die ausgefallen ist, da der Sättigungsgrad überschritten wurde.
Löslichkeit
Grundsatz: Gleiches löst sich in Gleichem.
Beispiel: Polare Stoffe sind hydrophil, lösen sich daher in H2O! Unpolare Stoffe sind hydrophob oder lipophil, lösen sich also in organische Lösungsmitteln.
Drei Fälle von gesättigter Lösung:
- Feststoff A und Lösung: nach dem Massenwirkungsgesetz ( MWG ) gilt: [A] = konstant!
- Zwei Flüssigkeiten sind entweder beliebig mischbar ( eine Phase ) oder begrenzt mischbar, wenn sich
zwei Phasen bilden ( heterogenes Gemisch).
- Gase in Flüssigkeit gelöst: K lässt sich nach Henry-Dalton berechnen, das heisst, K = pGas / [Gas]gelöst
Verteilung durch Adsorption:
Ein solches Gleichgewicht hängt von dem zu verteilenden Stoff, seiner Konzentration, dem Lösungsmittel, dem Adsorbens und der Temperatur ab.
Gleichgewichte an Membranen
Man betrachtet zwei Räume, die durch eine Membran getrennt sind. Die Konzentration eines Stoffes in beiden Räumen strebt danach sich auszugleichen.
- Wenn es grosse Poren hat, kann sich die Konzentration vollständig durch Diffusion ausgleichen.
- Sind die Poren der Membran ungefähr 10nm gross, ist die Membran nicht mehr für
alles durchlässig, sondern nur noch für das Lösungsmittel, kleine Moleküle und Ionen.
Das ermöglicht eine Trennung von hoch- und niedermolekularen Stoffen, was auch Dialyse genannt wird.
- Die Poren sind kleiner als 10nm: Membran ist nur noch durchlässig für Lösungsmittel,
wenn also Ionen und oder Moleküle gelöst werden, entsteht aufgrund des Lösungsmittelflusses
zum Konzentrationsausgleich ein Druck, der sogenannte osmotische Druck: posm = R * T * c
- Isotonisch bedeutet „mit gleichem osmotischen Druck“
- Kolligative Eigenschaft: nur abhängig von der Teilchenzahl, nicht von ihrer Natur; also zum Beispiel abhängig von posm.
Donnan-Gleichgewicht
Dieses Gleichgewicht stellt sich an einer semipermeablen Membran, die nur durchlässig für kleine Ionen und nicht für grosse Polyelektrolytionen ist. Es müssen zwei Bedingungen
erfüllt sein:
- Es muss Elektronenneutralität herrschen; das heisst, dass die zur Diffusion
befähigten Ionen solange hin und her fliessen bis die Ladung ausgeglichen ist.
- Das Produkt der Konzentration der kleinen Ionen auf beiden Seiten der Membran ist gleich. Es
bildet sich ein Donnan-Potential.
Einige Trennverfahren
- Destillation
- Sublimation (u.a. Gefriertrocknen)
- Flüssig/Flüssig Verteilung
- Dialyse
- Chromatographie
Chromatographie:
- stationäre Phase: Sie ist fest oder besteht aus einem Flüssigkeitsfilm an der Oberfläche eines Festkörpers
- mobile Phase: sie ist flüssig oder gasförmig je nach
Art der Chromatographie (Flüssigchromatographie, Gaschromatographie ). Die mobile Phase enthält den zu trennenden Stoff
in Lösungsmittel oder Trägergas
- Die Retentionszeit ist ein Mass dafür, wielange Stoffe in fester Phase festgehalten wurden bevor sie aus Kolonne austreten.
- Verteilungsgleichgewicht stellt sich bis 105 mal ein.
- Rf-Wert: Laufstrecke des Stoffes dividiert durch Laufstrecke des Lösungsmittels
- Es wird zur Identifikation, Reinheit- und Mengenbestimmung eines Stoffes angewendet.
|
