Allgemeine Fakten zu Atomkern, Elektronenhülle und Atombau allgemein:
- Elektron ist fast masselos, 5*10-4, seine Ladung beträgt 1.6*10-19C
- Proton hat die relative Masse 1, seine Ladung beträgt 1.6*10-19C
- Neutron hat ebenfalls die relative masse 1 und ist ungeladen
- Kernladungszahl, Ordunungszahl: Summe der Protonen im Kern
- Element ist ein Stoff aus Atomen gleicher OZ
- Atommasse befindet sich im Kern
- Nuklid ist ein Atom bestimmter OZ und MZ
- Isotope sind Atome gleicher OZ aber verschiedener MZ
Licht als elektromagnetische Strahlung
Elektronen können unter Energieaufwand aus ihrem Grundzustand in einen angeregten Zustand gehoben werden. Beim Zurückfallen in den Grundzustand wird die zugeführte Energie
in Form von Strahlung frei, wobei die Energiebeträge gequantelt sind, was bedeutet, dass einem Elektron nicht einfach irgendein Energiebetrag zugeführt werden
kann, sondern nur ein bestimmter, damit das Elektron einen Quantensprung machen kann.
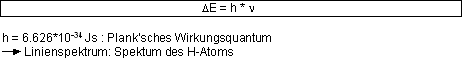
Quantenzahlen
Hauptquantenzahl: n : 1 (K), 2 (L), 3(M), 4, 5, 6
› stellen die Hauptniveaus dar
Nebenquantenzahl/Drehimpulsquantenzahl: l : l = 0 heisst s, l = 1 heisst p, l = 2 heisst d, l = 3 heisst f; l kann Werte von 0 bis n-1 annehmen
› unterteilen Hauptniveaus in Unterniveaus
Magnetquantenzahl: m : kann Werte von –l bis +l annehmen
› unterteilen Unterniveaus weiter
Spinquantenzahl: s : s entspricht immer +1/2 oder –1/2
› zeigt Drehrichtung des Elektrons um seine eigene Achse an
Elektronenkonfiguration
Wird entsprechend des Besetzungsschemas der Energiezustände durch Elektronen besetzt:
- tiefste Energie: Niveau von unten her auffüllen
- Pauli-Prinzip: Es kann nie zwei Elektronen geben, die in allen 4 Quantenzahlen übereinstimmen.
- Hund’sche Regel: maximale Spinmultiplitität
Die Elektronen der äussersten Schale heissen Valenzelektronen.
Orbitale
Ein Orbital ist ein Raum in der Elektronenhülle, in dem die Aufenthaltswahrscheinlichkeit für ein bestimmtes Elektron zwischen 0 und1 liegt.
Wenn man die Bahn eines Elekrons um den Atomkern bestimmen wollte, müsste man die Geschwindigkeit und die Lage zu jeder Zeit kennen. Elektronen haben aber Teilchen und Wellencharakter,
was mathematisch durch die Heisenberg'sche Unschärfe-Relation ausgedrückt wird.

Das Bohr'sche Atommodell beschreibt den Teilchencharakter und die Wellengleichung (Schrödinger Gleichung) den Wellencharakter.
Es gibt s-, p-, d-Orbitale, die die räumliche Verteilung der Ladungsdichte im Raum darstellen.
Die s-Orbitale sind kugelförmig und die p-Orbitale sind hantelförmig. |
