Reaktionskinetik
Die Reaktionskinetik beschäftigt sich mit der Geschwindigkeit, mit der die thermodynamisch voraussagbaren Zustandsänderungen erfolgen. Im allgemeinen besteht zwischen der Triebkraft einer
Zustandsänderung und der Geschwindigkeit, mit der sie abläuft, kein Zusammenhang. Die Thermodynamik ist eine Zustandsfunktion, die nach Definition unabhängig ist vom Weg. Hingegen ist
die Reaktionsgeschwindigkeit eben gerade abhängig vom eingeschlagenen Reaktionsweg. Somit kann man aus der gemessenen Reaktionsgeschwindigkeit auf den Weg einer Reaktion schliessen.
Reaktionsgeschwindigkeitsbestimmungen, Geschwindigkeitsgesetze und deren Konstanten gehören zur Reaktionskinetik.
Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit ist definiert als die Konzentrationsänderung eines Stoffes über der Zeit dieses Intervalls.
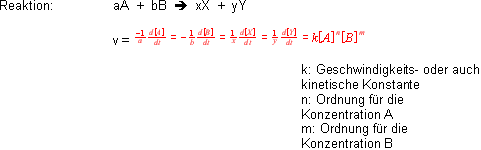
Für die Edukte betrachtet man die Abnahme der Konzentration, daher das Minuszeichen; für die Produkte entsprechend umgekehrt.
Chemische Reaktionen setzen sich oft aus mehreren aufeinanderfolgenden Elementarschritten zusammen. So sind dann die wirklich gemessenen Zeitgesetze für die beobachteten Reaktionen oft kompliziert.
Die experimentell gefundene Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit wird durch die Reaktionsordnung charakterisiert.
Achtung ganz wichtig: Man kann nicht aus der Stöchiometrie einer Reaktion auf die Ordnung schliessen. Also d.h. wenn man für das Edukt A im obigen Bsp. betrachtet so ist die Reaktion nter
Ordnung bezüglich A und mter Ordnung bezüglich B.
Halbwertszeit t1/2 für eine Reaktion 1. Ordnung
Gesucht: Halbwertszeit t1/2 einer Reaktion
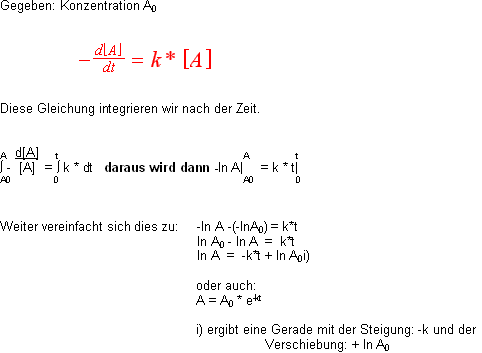
Für die Berechnung der Halbwertszeit setzen wir nun die bekannten Grössen ein:

Reaktionen 2. Ordnung
man geht analog zu den Gesetzen für die 1. Ordnung vor. Also man definiert die Reaktionsgeschwindigkeit.
A + B › AB
Die Geschwindigkeit dieser Reaktion hängt von zwei Konzentrationen ab. Man nennt Reaktionen dieses Typs auch bimolekular oder eben 2. Ordnung.

Reaktionen 0. Ordnung
Diese Form von Reaktionen kommen vorallem bei katalysierten Reaktionen und kat. Prozessen an Oberflächen vor.

Reaktionen 'Pseudo-0.-Ordnung'
Reaktionen Pseudo-Ordnung liegen vor, wenn ein Reaktand im Überschuss vorliegt. Das heisst die Konzentration dieser Reaktanden darf sich praktisch nicht verändern.
A + B › C; wobei B sehr gross
Wie laufen Reaktionen wirklich ab?
Reaktionen lauf meistens in mehreren aufeinander folgenden Schritten ab. Der langsamste Schritt ist der geschwindigkeitsbestimmende Schritt. Es gibt drei mögliche Elementarreaktionen:
- Unimolekular: 1 Teilchen reagiert allein; Geschwindigkeitsgesetz 1. Ordnung
- Bimolekular: 2 Teilchen reagieren miteinander; Geschwin-digkeitsgesetz 2. Ordnung
- Termolekular: 3 Teilchen reagieren miteinander; sehr selten; 3. Ordnung
Die Beobachtung der Elementarreaktionsabfolgen ergibt mögliche Reaktionsmechanismen. Elementarreaktionen lassen im weiteren den Schluss bezüglich der Reaktionsordnung zu. Jedoch nicht umgekehrt!
Also gültig ist:
Unimolekular › 1. Ordnung
Bimolekular › 2. Ordnung
Temperaturabhängigkeit der RG
Empirisch sieht man, dass die RG bei Erwärmung um 10°C etwa 2-3 mal schneller ist.

Katalyse
Ein Katalysator senkt die Aktivierungsenergie EA somit verläuft die Reaktion schneller. Achtung durch den schnelleren Verlauf einer Reaktion kann plötzlich ein Teilchen bevorzugt werden,
wobei es zu völlig neuen Produkten kommt.
Man unterscheidet homogene Katalyse und heterogene Katalyse.
heterogene Katalyse:
Bsp. katalytische Zersetzung von H2O2 mit Fe3+ oder I-, Verseifung, Veresterung (H+ katalysiert)
homogene Katalyse:
Bsp: NH3-Synthese; kat. Hydrierung mit Pt, Pd; Entfernung von NO2 aus Autoabgasen
Autokatalyse:
Die Reaktion produziert ihren eigenen Katalysator; Bsp: Radikal-Ketten, u.ä.
Kinetische Ableitung des MWG
Im Gleichgewicht einer Reaktion gilt ∆G = O, somit ist die Hinreaktion gleich gross wie die Rückreaktion.
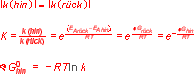
MWG
bei einer Reaktion: A + B = C
gilt der Reaktionsquotient Q.
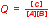
im Gleichgewicht entspricht Q = K.
K ist die Gleichgewichtskonstante. Achtung: diese ist nur definiert für den Gleichgewichtszustand. Die GG-Konstante ist auch temperaturabhängig.
Übungen zur Kinetik
Die Reaktionsgeschwindigkeit der Reaktion N t X + Z hängt nur von ab. Die Reaktionsgeschwindigkeit beträgt vN: -0.0080 mol*l-1s-1 bei = 0.2 M. Wie gross ist k, wenn die Reaktion nach
a) der nullten
b) der ersten
c) der zweiten Ordnung abläuft.
|
